
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електронні конфігурації атомів перших двадцяти елементів періодичної системи Д. І. Менделeєва
Правило Клечковського: Порядок заповнення енергетичних станів визначається прагненням атома до мінімального значення суми головного та побічного квантових чисел. Якщо сума п + l однакова для двох станів, то перевагу віддають тому, для якого п мінімальне.
Правило Хунда: Електрони розміщуються на однакових орбіталях таким чином, щоб сумарний спін був максимальним.
Принцип Паулі: B атомі не може бути електронів з однаковим значенням усіх чотирьох квантових чисел.
Наприклад, розглянемо використання правила Клечковського для визначення розподілу електронів за орбіталями для Калію К (Z= 19) і Скандію S (Z= 21).
1. Елемент Аргон (Z 18) має такий розподіл електронів а орбіталями:
1s22s22p63s23p6
При розподілі електронів за орбіталями в атомі К у відповідності з правилом Клечковського перевага віддається орбіталі 4s (cума квантових чисел п + l дорівнює 4 + 0 = 4) порівняно з орбіталлю 3d (сума квантових чисел п + l дорівнює 3 + 2 = 5) як орбіталі, що має мінімальне значення п +l
Отже, для атома К: 1s22s22p63s23p64s1.
2. Елемент Кальцій, що стоїть перед Скандієм, (Z = 20), має такий розподіл електронів за орбіталями: 1s22s22p63s23p64s2.
З орбіталей 3d (п + l дорівнює 3 + 2 = 5) і 4р (п + l дорівнює 4+1 = 5) при розподілі електронів в атомі Sс перевагу слід віддати орбіталі 3d як орбіталі, що має мінімальне значення п = 3 при однакових сумах квантових чисел п + l, які дорівнюють 5.
Скандій характеризується таким розподілом електронів за орбіталями: 1s22s22p63s23p64s23d1.
В таблиці 2.1.6 представлені електронні конфігурації атомів перших двадцяти елементів періодичної системи Д. І. Менделєєва.
Таблиця 2.1.6.
| Порядковий номер елемента | Шар | К | L | M | N |
| п | |||||
| l | 0 1 | 0 1 2 | 0 1 | ||
| підрівень | 1s | 2s 2р | 3s 3p 3d | 4s 4p | |
| число електронів на даному підрівні | |||||
| Н | |||||
| Не | |||||
| Li | |||||
| Ве | |||||
| В | 2 1 | ||||
| С | 2 2 | ||||
| N | 2 3 | ||||
| O | 2 4 | ||||
| F | 2 5 | ||||
| Ne | 2 6 | ||||
| Na | 2 6 | ||||
| Мg | 2 6 | ||||
| А1 | 2 6 | 2 1 | |||
| Sі | 2 6 | 2 2 | |||
| Р | 2 6 | 2 3 | |||
| S | 2 6 | 2 4 | |||
| Cl | 2 6 | 2 5 | |||
| Аr | 2 6 | 2 6 | |||
| К | 2 6 | 2 6 | |||
| Са | 2 6 | 2 6 |
4. Розміщення електронів по орбіталях.
Будову електронних оболонок атомів елементів прийнято записувати за допомогою електронних формул. Електронну структуру атома Гідрогену, що перебуває в незбудженому стані, можна записати формулою 1s1 або подати
 | 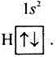 | ||
| , |
схемою атома Гелію — формулою 1s2 або схемою
У цих електронних формулах арабськими цифрами позначають енергетичні рівні, а латинськими літерами — підрівні.
Вгорі, справа від літери, що позначає тип орбіталі, зазначається арабськими цифрами число електронів на даному підрівні.
В атомі Літію, з якого починається другий період, третій електрон уже не може розміститись на орбіталі першого (К) електронного шару, тому він займає s-орбіталь другого шару (L). Електронна формула атома Літію 1s22s1, a схематичне зображення його

Ця схема показує, що електрони Літію (а їх три) розміщені на двох енергетичних рівнях: перший від ядра рівень, який складається з одного підрівня, повністю заповнений електронами; другий рівень, останній, складається з двох підрівнів (2s і 2р),причому 2s-підрівень має тільки одну орбіталь, на якій розміщується один неспарений електрон, три орбіталі 2p-підрівня, яким відповідає вищий рівень енергії, ніж 2 s -підрівню, залишаються вільними від електронів.
Атом Берилію має чотири електрони, його електронна структура записується формулою 1 s 22s2 або зображується схемою
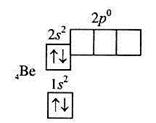 |
Із збільшенням заряду ядра на одиницю п'ятий електрон заповнює 2p-під-рівень і електронна формула атома Бору матиме вигляд 1s22s22p1 В атома Карбону число електронів на 2p-підрівні зростає до 2; електронна формула атома Карбону 1s22s22p2. Згідно з правилом Гунда, два p-електрони розміщуються так, щоб спіни їх були паралельними:
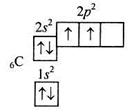 |
Аналіз атомного спектра Карбону показав, що для незбудженого стану атома Карбону справедлива схема, що відповідає найбільшому можливому значенню сумарного спіна атома (сума спінів усіх електронів, що входять до складу атома).
Читайте також:
- I. Органи і системи, що забезпечують функцію виділення
- I. Особливості аферентних і еферентних шляхів вегетативного і соматичного відділів нервової системи
- II. Анатомічний склад лімфатичної системи
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- IV. Розподіл нервової системи
- IV. Система зв’язків всередині центральної нервової системи
- IV. Філогенез кровоносної системи
- POS-системи
- VI. Філогенез нервової системи
- Автокореляційна характеристика системи
- АВТОМАТИЗОВАНІ СИСТЕМИ ДИСПЕТЧЕРСЬКОГО УПРАВЛІННЯ
- АВТОМАТИЗОВАНІ СИСТЕМИ УПРАВЛІННЯ ДОРОЖНІМ РУХОМ
| <== попередня сторінка | | | наступна сторінка ==> |
| Розподіл електронів за квантовими рівнями | | | Лекція № 6 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |