
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
Хімічними явищами (або хімічними реакціями) називаються такі явища, під час перебігу яких відбуваються перетворення одних речовин на інші, що відрізняються від вихідних складом, будовою та властивостями.
Класифікація хімічних реакцій.
Тема 4.1. Хімічні реакції
Лекція № 11
1. Класифікація хімічних реакцій.
Приклади хімічних явищ: окиснення, горіння, ржавіння, гниття, бродіння, розкладання, ізомеризація і т. ін.
Речовини, що вступають у хімічну реакцію, називаються вихідними речовинами, або реагентами.
Речовини, які утворюються внаслідок перебігу реакції, називаються продуктами реакцій.
Під час хімічної реакції молекули вихідних речовин руйнуються, а атоми, перегруповуючись, утворюють молекули нових речовин — продуктів реакції. При цьому атоми або не змінюються взагалі, або зміни відбуваються на електронному рівні, внаслідок приєднання або відняття електронів.
Про те, що подане явище є хімічним (хімічною реакцією), можна судити за характерними ознаками:
Ø утворення осаду:
AgNO3 + HC1 = AgCl↓ + HNO3
білий
осад
Ø виділення газу:
NaHCO3 + НС1 = NaCl + СО2↑ + Н2О
газ
Ø зміна забарвлення:
FeCl3 + 3KSCN = 3КС1 + Fe(SCN)3
жовтий безбарвний червоний
Ø поя ва запаху:
FeS + 2HC1 = FeCl2 + H2S↑
запах тухлих яєць
Ø виділення тепла:
H2SO4 + 2KOH = K2SO4 + 2H2O + Q
тепло
Ø виділення тепла та світла:
СН4 + 2О2 = СО2 + 2Н2О + Q + hv
тепло світло
Найбільш загальною ознакою хімічної реакції є зміна кількості вихідної речовини (або продукту реакції) порівняно з кількістю відповідних речовин в момент утворення реакційної суміші.
Для виникнення хімічної реакції необхідні:
1) наявність тісного контакту між реагуючими речовинами;
2)велика площа їх стикання. Це досягається подрібненням та перемішуванням речовин. Найбільший ступінь подрібнення речовин (до молекул та іонів) досягається під час їх розчинення, тому у водних розчинах та газоподібній фазі реакції відбуваються легко;
3) підведення енергії для ініціювання початку реакції (нагрівання,
опромінення);
4) тиск, вищий за атмосферний (в реакціях між газами);
5) наявність каталізатора.
Для перебігу хімічної реакції необхідні:
1) постійне надходження реагентів до зони реакцій;
2) постійне підтримування умов, які забезпечують виникання взаємодії між
молекулами реагуючих речовин (відведення продуктів реакцій, підтримування постійних температури та тиску, перемішування та ін.).
У деяких випадках умови, які забезпечують взаємодію речовин, створюються внаслідок самої реакції. Такі реакції, почавшись, відбуваються далі самі по собі та називаються ланцюговими. Наприклад, для початку реакції горіння необхідно нагріти речовину та кисень до певної температури, яка називається температурою займання. Тоді реакція горіння відбувається повільно, тому що енергії, яка виділяється в ході реакції, досить для ініціювання нових актів взаємодії, а конвекція повітря, що виникає під час горіння, забезпечує постійне надходження кисню до зони горіння. Для припинення горіння досить порушити хоча б одну з умов перебігу такої реакції: охолодити (залити водою, засипати піском) чи обмежити доступ кисню (накрити ковдрою, засипати піском).
Хімічні реакції класифікують за такими ознаками:
І. За зміною числа вихідних і кінцевих речовин:
1) Реакції сполучення, під час яких з двох або кількох речовин утворюється одна.
2Na + Cl2→2NaCl Р2О5 +3Н2O→ 2Н3РО4
В органічній хімії реакції сполучення називаються реакціями приєднання.
CН2= CН2+ НCl→ CН3 – CН2Cl (хлоретан)
етен
2) Реакції розкладу, під час яких з однієї речовини утворюються декілька простих або складних речовин.

 Си(ОН)2 t
Си(ОН)2 t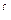 CuO + H2O; 2HgO t
CuO + H2O; 2HgO t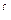 2Hg + O2 ↑
2Hg + O2 ↑
В органічній хімії назви таких реакцій складаються з префікса «де» і назви речовини, що відщеплюється.
 CН3 – CН3 t
CН3 – CН3 t 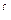 .Ni CН2=CН2 + Н2 (дегідрування)
.Ni CН2=CН2 + Н2 (дегідрування)
 С2Н5ОН t
С2Н5ОН t 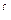 H
H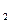 SO
SO CН2= CН2 + H2O (дегідратація)
CН2= CН2 + H2O (дегідратація)
3) Реакції заміщення, під час яких атоми простої речовини заміщують атоми в молекулах складної речовини.
2НCl +Zn → ZnCl2+ Н2↑ СиSO4+Fe→ Fe SO4+Си
В органічній хімії реакціями заміщення називають реакції, під час яких атоми простих речовин або групи атомів складних речовин займають місце якогось атома в складній речовині з утворенням двох складних речовин.
 CН4+ Cl2 h V CН3Cl+НCl
CН4+ Cl2 h V CН3Cl+НCl
 С6Н6 + HO – NO2 H
С6Н6 + HO – NO2 H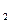 SO
SO С6Н5 NO2+ H2 O
С6Н5 NO2+ H2 O
4) Реакції обміну, під час яких молекули складних речовин обмінюються складовими частинами
CuSO4 + 2NaOH → Cu(OH)2+Na2SO4
В органічній хімії СН3СООН + NaOH→СН3СООNa+H2O
Читайте також:
- III. Вимоги до учасників, складу груп і керівників туристських подорожей
- IV. Запасні речовини
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Аварії з викидом (загрозою викиду) сильнодіючих отруйних речовин на об'єктах економіки.
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аваріїз витоком сильнодіючих отруйних речовин.
- Агрегатні стани речовини
- АДАПТАЦІЯ ОБМІНУ РЕЧОВИН ДО М'ЯЗОВОЇ ДІЯЛЬНОСТІ
- Азот, фосфор, біогенні елементи та їх сполуки, органічні речовини
| <== попередня сторінка | | | наступна сторінка ==> |
| Способи вираження концентрації істинних розчинів. | | | III. За виділенням або поглинанням енергії |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |