
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Способи вираження концентрації істинних розчинів.
В істинних розчинах частинки дисперсної фази (атоми, молекули, іони) мають розмір, менший від 1 нм.
Нм.
У колоїдних розчинах частинки дисперсної фази тверді й мають розмір
Види розчинів
| Розчинник (безперервна фаза) | Розчинена речовина (дисперсна фаза) | Умовні позна-чення | Приклади |
| Рідина | Тверда речовина | р. —тв. | Водні розчини солей |
| Рідина | Рідина | р.-р. | Розчини спирту у воді, оцтової кислоти у воді |
| Рідина | Газ | p. —г. | Газована вода |
| Тверда речовина | Тверда речовина | тв. — тв. | Сплави, мармур |
| Тверда речовина | Рідина | тв. — р. | Перли, желе |
| Тверда речовина | Газ | тв. — г. | Пемза, лава, пінополіуретан |
| Газ | Тверда речовина | г. — тв. | Дим, пил у атмосфері, хмари |
| Газ | Рідина | r. — p. | Туман . |
| Газ | Газ | г. —г. | Повітря |
Узалежності від агрегатного стану та розміру частинок розчиненої речовини (або дисперсної фази) системи поділяються на:
• грубодисперсні (суспензії, емульсії);
• тонкодисперсні (колоїдні розчини);
• істинні розчини.
У грубодисперсних системах частинки дисперсної фази мають розмір, більший за 100нм та можуть бути або рідкими (емульсії), або твердими (суспензії). Такі системи називають ще зависями.
Системи, в яких частинки твердої речовини розподілені в рідині, називаються суспензіями.
Наприклад: суміш глини з водою, суміш мулу або крейди з водою.
Системи, в яких частинки однієї рідини розподілені в іншій рідині, називаються емульсіями.
Наприклад: молоко, маргарин, олія, крем, мазі.
Істинні розчини поділяються:
– за типом розчинника — на водні та неводні;
– за типом розчиненої речовини — на розчини солей, кислот, лугів, газів і т.п.;
– за відношенням до електричного струму — на електроліти та неелектроліти;
– за консистенцією — на концентровані та розведені;
– за ступенем досягнення межі розчинності — насичені та ненасичені.
Склад розчину можна виразити як концентрацією так і часткою розчиненої речовини.
Концентрація розчинівхарактеризує якісні і кількісні співвідношення між компонентами в системі.
До якісних характеристик відносять такі поняття, як розведені і концентровані розчини; ненасичені, насичені і пересичені розчини. Для добре розчинних речовин ці поняття співпадають. Так, насичений розчин NaCl, є одночасно концентрованим, а розведений – ненасиченим. Для розчинів малорозчинних речовин поняття "концентрований" неприйнятне, бо навіть насичений розчин в даному випадку завжди розведений. Насичений розчин буде стійким тільки тоді, коли він знаходиться в контакті з іншою фазою. У відсутності такого контакту насичений розчин можна легко перетворити як в ненасичений, так і в пересичений.
Серед кількісних способів вираження концентрації найчастіше зустрічаються й застосовуються масова частка і молярна концентрація.
Масова частка(ω) визначається відношенням маси розчиненої речовини X до маси всього розчину (в частках одиниці чи у відсотках):
ω =  ω =
ω = 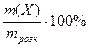 (11)
(11)
причому зовсім байдуже, яка речовина розчиняється та яка її малярна маса. Масова частка показує, скільки грамів речовини міститься в 100г розчину. Наприклад, якщо в 450 г води розчинити 50 г будь-якої речовини, то масова концентрація розчину (0 = 50/(450+50) = 0,1 або 10%, а для того, щоб приготувати 100 грамів такого розчину, треба взяти 10 г речовини і розчинити їх у 90 г води.
Щоб приготувати 100 г 2,5%-го розчину, треба взяти 2,5 г речовини X і 97,5 г води. 400 грамів такого розчину містять 2,5 ∙ 4 = 10 г речовини X та 400 - 10 = =390 г води. Для розрахунків можна скористатися й формулою (11):
m(X) = 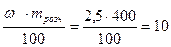
Молярна концентрація с(Х) - це відношення кількості розчиненої речовини X l jоб'єму розчину:
c(X) = 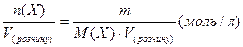
Щоб приготувати одномолярний (1М) розчин, наприклад NaCl, треба взяти 58,5 г (молярна маса) солі на 1 л розчину. В 1л 0,2-молярного (0,2 М) розчину NaCl міститься 58,5 ∙ 0,2 = 11,7 г солі, а в 20 л - у 20 разів більше, тобто 11,7 ∙20= 234 г NaCl
Той же розрахунок за формулою (12):
m(NaCl) = c(NaCl) ∙ M(NaCl) ∙V(розч) = 0,2 ∙ 58,5 ∙ 20 = 234 (г).
Такий спосіб вираження концентрації передбачає знання молекулярної формули розчиненої речовини, щоб можна було вирахувати її молярну масу.
Кількісний склад розчину можна виражати через моляльність— число молів розчиненої речовини, що міститься в 1000 г розчинника.
Іноді (на виробництві) склад розчину виражають через його густину. Для розчину кожної речовини, що має певну густину, характерний певний вміст цієї речовини. Густину розчину наближено визначають спеціальним приладом — ареометром. Знаючи густину розчину, за спеціальними таблицями можна встановити масову частку розчиненої речовини у відсотках.
Склад розчину можна також виражати титром. Титромназивають кількість грамів розчиненої речовини, що міститься в 1мл розчину. Якщо в 1л сульфатної кислоти з концентрацією 1н міститься 49,04г H2SO4, то титр цього розчину становитиме
ТН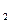 SO
SO =
=  = 0,04904 г/мл
= 0,04904 г/мл
Розчинність речовин часто виражають масою речовини, що міститься в 100 масових частках розчинника. Наприклад, розчинність хлориду натрію за температури 18°С дорівнює 35,86 г у 100г води.
Якщо реакції відбуваються між розчинами речовин, їх склад зручно виражати через молярну концентрацію еквівалента. У цьому разі легко обчислити, в яких об'ємних відношеннях слід змішати розчини, щоб розчинені речовини прореагували без залишку.
Основна перевага цих (0,1н, 0,01 н і т. д.) розчинів полягає в тому, що розчини однакової концентрації реагують між собою в однакових об'ємних співвідношеннях. Так, для нейтралізації 1л 1н розчину хлоридної кислоти потрібно точно 1л 1н розчину гідроксиду натрію, оскільки кожен із цих розчинів містить по одному еквіваленту речовини в 1л.
Зрозуміло, що чим концентрованіший розчин ми маємо, тим у меншому об'ємі його міститиметься така сама кількість розчиненої речовини, як і в певному об'ємі більш розбавленого розчину. Отже, між об'ємом розчину і його молярною концентрацією еквівалента існує обернено пропорційна залежність:
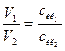 , або V1cек
, або V1cек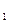 = V2cек
= V2cек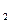
За цією залежністю можна не тільки обчислювати об'єми розчинів, потрібні для проведення реакцій, а й за об'ємами розчинів, що беруть участь у реакції, знаходити їхні концентрації.
Завдання для самоперевірки:
1. Задача. У лабораторії є розчин з масовою часткою гідроксиду натрію 30%, густина якого 1,33г/мл. Який об′єм цього розчину треба взяти для приготування розчину об′ємом 250мл. з масовою часткою гідроксиду натрію 14% і густиною 1,15г/мл.?
2. Задача. Нітрат калію масою 10г розчинили у воді об′ємом 150мл. Густина дорівнює 1г/мл. Розрахуйте масову частку солі в розчині.
3. Задача. Сірководень об′ємом 14мл розчинили у воді мсою 500г (н.у.) Обчисліть масову частку сірководню в розчині.
4. Задача. Визначте молярну концентрацію розчину, добутого внаслідок розчинення Na2SO4 масою 21,3г у воді масою 150г, якщо густина добутого розчину дорівнює 1,12г/мл.
Тестові завдання по темі «Хімічний зв’язок і будова речовини»
| № з/п | Питання | Відповіді | |||
| 4.1.1.Укажіть, енергія якого хімічного зв'язку найменша: | металічного | йонного | водневого | ковалентного | |
| 4.1.2.Укажіть, енергія якого хімічного зв'язку найбільша: | металічного | йонного | водневого | ковалентного | |
| 4.1.3.Визначте порядок зв'язку в молекулі азоту: | потрійний | подвійний | ординарний | кратний | |
| 4.1.4.Визначте порядок зв'язку в молекулі кисню: | потрійний | подвійний | ординарний | кратний | |
| 4.1.5.Визначте порядок зв'язку в молекулі хлору: | потрійний | подвійний | ординарний | кратний | |
| 4.1.6.Укажіть, як змінюється полярність та міцність зв'язку в ряді молекул HF-HCl-HBr: | як полярність, так і міцність зв'язку зростають | полярність зв'язку зростає, а міцність зменшується | як полярність, так і міцність зв'язку зменшуються | полярність зв'язку зменшується, а його міцність зростає | |
| 4.1.7.Укажіть, як змінюється міцність зв'язку в ряді молекул F2-O2-N2: | зростає | не змінюється | зменшується | спочатку зменшується, а потім зростає | |
| 4.1.8.Укажіть тип орбіталей атомів Гідрогену та Хлору відповідно, які перекриваються у процесі утворення молекули НС1: | s і s | s і р | р і р | р і s | |
| 4.1.9.Укажіть тип орбіталей атомів Флуору, які перекриваються у процесі утворення молекули F2: | s і s | s і р | р і р | р і s | |
| 4.1.10.Укажіть тип орбіталей атомів Гідрогену, які перекриваються у процесі утворення молекули Н2: | s і s | s і р | р і р | р і s | |
| 4.1.11.Укажіть формулу речовини з іонним типом зв'язку: | С12 | Н2О | Р4 | KF | |
| 4.1.12.Укажіть формулу речовини з ковалентним неполярним типом зв'язку: | РН3 | Н2 | СаС12 | NaF | |
| 4.1.13.Укажіть формулу речовини з іонним типом зв'язку: | НВr | С12 | КС1 | Н2О | |
| 4.1.14.Укажіть формулу речовини з ковалентним полярним типом зв'язку: | F2 | H2S | NaF | КС1 | |
| 4.1.15.Укажіть формулу речовини з ковалентним неполярним типом зв'язку: | О2 | КВr | NH3 | СН4 | |
| 4.1.16.Укажіть формулу речовини з ковалентним полярним типом зв'язку: | NaCl | H2S | О2 | LiF | |
| 4.1.17. Тільки ковалентні неполярні зв'язки присутні в речовинах: | Р4 | NH3 | N2 | Н2О | |
| 4.1.18. Тільки ковалентні полярні зв'язки присутні в речовинах: | NH3 | Р4 | Н2О | Н2О2 | |
| 4.1.19. Укажіть формулу речовини з найбільшою кількістю ковалентних зв'язків: | НС1 | N2 | СН4 | F2 | |
| 4.1.20. Укажіть формулу речовини з найбільшою кількістю ковалентних зв'язків: | H2S | РН3 | О2 | Н2 | |
| 4.1.21. Укажіть речовину, в якій хімічний зв'язок найменш полярний: | НС1 | НІ | Н F | НВr | |
| 4.1.22.Укажіть речовину, в якій хімічний зв'язок най.1 більш полярний: | гідрогенсульфід | хлор | метан | гідрогенхлорид | |
| 4.1.23.Укажіть характерну фізичну властивість речовини з металічним типом зв'язку: | прозорість | леткість | крихкість | пластичність | |
| 4.1.24.Установіть відповідність між речовинами та їхніми типами хімічних зв'язків: Речовина а) вольфрам; б) алмаз; в) амоніак; г) натрій хлорид | Тип зв'язку: йонний | Тип зв'язку: ковалентний полярний | Тип зв'язку: ковалентний неполярний | Тип зв'язку: металічний | |
| 4.1.25.Установіть відповідність між речовинами та їхніми типами хімічних зв'язків: Речовина а) озон; б) срібло; в) кальцій оксид; г) вода. | Тип зв'язку: йонний | Тип зв'язку: ковалентний полярний | Тип зв'язку: ковалентний неполярний | Тип зв'язку: металічний | |
| 4.1.26.Укажіть формулу речовини, що має іонну кристалічну решітку в твердому стані: | Н2О | І2 | С (алмаз); | NaCl | |
| 4.1.27. Укажіть формулу речовини, що має атомну кристалічну решітку в твердому стані: | Н2О | І2 | С (алмаз); | NaCl | |
| 4.1.28.Укажіть речовину, якій відповідає такий опис: складається з атомів двох неметалів, зв'язок у її молекулі — ковалентний, за звичай-них умов — газ. | натрій хлорид | калій оксид | купрум(ІІ) хлорид | бромоводень | |
| 4.1.29.Укажіть речовину, якій відповідає такий опис: складається з атомів металу та неметалу, зв'язок у сполуці — йонний, за звичайних умов — тверда, добре розчинна у воді. При розв'язанні завдань 4.1.30-4.1.35 скористайтесь табл. 8 (додаток). | амоніак | цинк оксид | купрум(ІІ) хлорид | кальцій карбонат | |
| 4.1.30.Укажіть, у якому ряді наведено речовини з атомною, молекулярною та іонною кристалічними решітками в твердому стані: | алмаз, натрій хлорид, графіт | білий фосфор, вода, водень | силіцій(ГУ) оксид, мідь, азот; | алмаз, фтор, калій фторид | |
| 4.1.31.Охарактеризуйте властивість речовини з молекулярною кристалічною решіткою: | легкоплавка | летка | добре проводить електричний струм | тугоплавка | |
| 4.1.32. Охарактеризуйте властивість речовини з атомною кристалічною решіткою: | легкоплавка | летка | добре проводить електричний струм | тугоплавка | |
| 4.1.33.Установіть відповідність між речовинами та типами кристалічних решіток: Властивість а) силіцій(ІV) оксид; б) нікель; в) калій бромід; г) фтор. | Тип решітки: іонна | Тип решітки: молекулярна | Тип решітки: атомна | Тип решітки: металічна | |
| 4.1.34.Установіть відповідність між типами кристалічних решіток та фізичними властивостями речовин: Тип решітки а) молекулярна; б) йонна; в) атомна; г) металічна. | Властивість: крихкість та добра роз- чинність у воді | Властивість: леткість та низька тепліпровідність | Властивість: пластичність та висока теплопровідність | Властивість: крихкість та висока твердість | |
| 4.1.35.Установіть відповідність між фізичними властивостями речовин та типами кристалічних решіток: Властивість а) добра електрична провідність розчину; б) леткість; в) висока твердість; г) ковкість. | Тип решітки: йонна | Тип решітки: молекулярна | Тип решітки: атомна | Тип решітки: металічна |
Тестові завдання по темі «Розчини»
| № з/п | Питання | Відповіді | |||
| 5.1.1.Укажіть правильне твердження, яке характеризує розчин: | речовина, що має рідкий агрегатний стан | однорідна суміш речовин | хімічна сполука | гетерогенна система, що містить декілька речовин | |
| 5.1.2.Укажіть правильне твердження, яке характеризує насичений розчин: | може бути розведеним | не може бути розведеним | завжди є концентрованим | не завжди є концентрованим | |
| 5.1.3.Укажіть, як можна ненасичений розчин зробити насиченим: | додати воду | упарити розчин | розчинити додаткову кількість речовини | всі попередні відповіді неправильні | |
| 5.1.4.Розчин, що містить досить малу масу розчиненої речовини порівняно з масою розчинника, називають: | розведеним | концентрованим | насиченим | ненасиченим | |
| 5.1.5.Розчин, що містить досить значну масу розчиненої речовини порівняно з масою розчинника, називають: | розведеним | концентрованим | насиченим | ненасиченим | |
| 5.1.6.Укажіть, на які види за агрегатним станом поділяються всі розчини: | рідкі | тверді | газоподібні | правильні всі твердження | |
| 5.1.7.Густина розчину є відношенням: | маси розчиненої речовини до об'єму розчину | маси розчиненої речовини до маси розчину | маси розчину до об'єму розчину | маси розчинника до маси розчину | |
| 5.1.8.Зі зміною температури розчинність твердих речовин у рідинах: | завжди знижується | завжди зростає | змінюється неоднозначно | не змінюється | |
| 5.1.9. Одиницями вимірювання масової частки є: | моль/л | відсотки | моль/кг | частки одиниці | |
| 5.І.10. Основоположником фізичної теорії розчинів був: | Д. І. Менделєєв | М. В. Ломоносов | Я. Г. Вант-Гофф | С. Арреніус | |
| 5.1.11.Основоположником хімічної теорії розчинів був: | Д. І. Менделєєв | М. В. Ломоносов | Я. Г. Вант-Гофф | С. Арреніус | |
| 5.1.12.Сукупність усіх процесів, які виникають внаслідок появи у воді розчиненої речовини, називають: | розчиненням | гідратацією | сольватацією | дисоціацією | |
| 5.1.13. Сукупність усіх процесів, які виникають внаслідок появи в розчиннику розчиненої речовини, називають: | розчиненням | гідратацією | сольватацією | дисоціацією | |
| 5.1.14.До кристалогідратів належать речовини: | H2SO4-6H2O (рідина) | ВаС12-2Н2О (тверда речовина); | С2Н5ОН-ЗН2О (рідина); | CuSO4 5Н2О (тверда речовина). | |
| 5.1.15.До кристалогідратів належать речовини: | H2SO4 -2H2O (рідина) | Na2SO4 • 10Н2О (тверда речовина) | FeSO4 -7Н2О (тверда речовина) | Na2CO3 10Н2О (тверда речовина) |
Вправи по темі “ Хімічний зв'язок і будова речовин „
1. Визначте тип хімічного зв’язку в наведених речовинах ( іонний, ковалентний полярний, ковалентний неполярний) (табл.1 ). Складіть схеми утворення хімічного зв’язку в речовинах. Дайте назви речовинам.
Таблиця 1
| Варіант | Речовини | Варіант | Речовини |
| BeCl2, H2O, CaH2, PF3 | PCl3, O2, AlN, Mq3, N2 | ||
| NaCl, CH4, Al2O3, Cl2 | Ls2O, KH, SnS, Cl2 | ||
| Li2O, SnO, H2, PH3 | CF4, Fe2O3, Br2, HCl | ||
| K2S, F2, BeS,H2S | PH3, CCl4, B2O3, I2 | ||
| CaF2, SnCl2, LiCl, H2S | Na2O, PCl3, CuO, H2 | ||
| CaO, N2, PCl3, NaH | BeF2, H2S, CaCl2, F2 | ||
| NH3, B2O3, CCl4, Br2 | Li2S, I2, CS2, H2Se | ||
| FeCl3, O2, MqO, AlN | NaBr, CO2, Cl2, Al2O3 |
2. Визначте валентності хімічних елементів у сполуках (табл. 2). Складіть
структурні формули речовин.
Таблиця 2
| Варіант | Речовини | Варіант | Речовини |
| PCl3, Na2, SO4, Al(OH)3, Mq3N2 | CaH2, H2O, BeCl2, CaCO3 | ||
| Li2O, KOH, SnS, K2SiO3 | NaCl, Cr(OH)3, CH4, CO2 | ||
| Mq(OH)2, Fe2O3, Cu(NO3)2, HCl | Li2O, Sn(OH)2, PH3, Na2SiO3 | ||
| PH3, H2CO3, B2O, K2SO3 | K2S, NO2, BeS, H2SO4 | ||
| Na2O, PCl3, Cu(OH)2, ZnCl2 | Ba(OH)2, SnCl2, LiI, H2O | ||
| CaCl2, H2S, BeF2, Al2O3 | CaO, NaH, PCl3, Fe(OH)2 | ||
| Na3PO4, CS2, H2Se, Li2S | NH3, CCl4, B2O3, H3PO4 | ||
| CO2, NaBr, Ca(OH)2, Cr2O3 | FeCl3, MqO, Pb(OH)2, AlN |
Задачі по темі : “ Розчини „
1. У воді масою 150 г розчинили калій хлорид масою 10 г . Визначте масову частку солі в отриманому розчині.
2. Визначте масу солі, потрібної для приготування розчину масою 2 кг з масовою часткою солі 15 %.
3. Визначте масу калій хлориду, який потрібно розчинити у воді масою 100 г, щоб отримати розчин з масовою часткою КСl 5%.
4. Барій Хлорид масою 6 г розчинили у воді об’ємом 250 мл (густина 1 г/мл ).
Визначте масову частку солі в отриманому розчині.
5. У воді масою 1000 г розчинили калій сульфат, кількість речовини якого становила 2 моль. Визначте масову частку солі в розчині.
6. Визначте кількість речовини натрій гідроксиду, потрібно приготування розчину масою 60 г з масовою часткою лугу 15 %.
7. Визначте масу солі і масу води, потрібних для приготування розчину об’ємом 120мл (густина 1,1 г/мл) з масовою часткою солі 15 %.
8. У воді об’ємом 200 мл (густина 1 г/мл) розчинили кристалогідрат СаСl2∙6H2O масою 25 г . Визначте масву частку кальцій хлориду в отриманому розчині.
9. Розчин купрум (ІІ) сульфату масою 400 г (масова частка СuSO4 – 15 %) випарили, добувши кристалогідрат СuSO4 ∙5H2O. Визначте масу добутого кристалогідрату.
10. Визначте, яка маса кристалогідрату Na2SO4∙10H2O і який об’єм води потрібний для приготування розчину натрій сульфату (ρ=1,091 г/мл) об’ємом 1,2 л, у якому його масова частка складає 10 %.
11. Для приготування 5%-го (за масою) розчину магній сульфату узято 400 г
кристалогідрату MqSO4 ∙ 7H2O. Визначте масу отриманого розчину.
12. Визначте, у якій масі води потрібно розчинити 25 г кристалогідрату СuSO4 ∙5H2O, щоб одержати 8%-ий ( за масою) розчин купрум (ІІ) сульфату.
13. Визначте, скільки грамів кристалогідрату Na2SO4∙10H2O треба розчинити в 800 г води, щоб одержати 10 %-ий (за масою) розчин натрій сульфату.
14. Визначте масу кристалогідрату FeSO4 ∙ 7H2O, потрібного для приготування
розчину масою 50 г з масовою часткою ферум (ІІ) сульфату 8%.
15. Гідрогенхлорид об’ємом 5,6 л (нормальні умови) розчинили у воді масою 500 г. Визначте масову частку HCl в отриманому розчині.
16. Визначте, який об’єм сульфур (ІV) оксиду, виміряний за нормальних умов,
потрібний для приготування розчину масою 200 г з масовою часткою SO2 1,5 %.
17. Визначте об’єм гідроген хлориду, виміряний за нормальних умов, потрібний для приготування розчину масою 500 г з масовою часткою HCl 8%.
18. Гідроген бромід об’ємом 1,12 л (нормальні умови) розчинили у воді масою 150 г. Визначте масову частку гідроген бромід в отриманому розчині.
19. Визначте об’єм розчину сульфатної кислоти (масова частка H2SO4 8 %, густина1,05 г/мл), який необхідно взяти для приготування розчину з масовою часткою сульфатної кислоти 2 % об’ємом 400 мл (густина-1,01 г/мл).
20. Потрібно приготувати розчин натрій нітрату масою 300 г (масова частка NaNO3 5 %). Визначте об’єм води та об’єм розчину з масовою часткою натрій нітрату 16 % (густина-1,11 г/мл), необхідних для цього.
21. До розчину сульфатної кислоти об’ємом 250 мл (масова частка H2SO4 12 %,
густина 1,08 г/мл) прилили воду масою 120 г. Визначте масову частку сульфатної кислоти в отриманому розчині.
22. До розчину солі масою 250 г (масова частка солі 10 %) долили воду об’ємом 150мл (густина- 1 г/мл).Визначте масову частку солі в отриманому розчині.
23. Визначте об’ємом розчину калій гідроксиду (масова частка КОН 12 %, густина 1,11 г/мл), який потрібно долити до води об’ємом 500 мл , щоб отримати розчин з масовою часткою калій гідроксиду 5 %.
24. Визначте маси розчинів кальцій хлориду з масовими частками СаСl2 2і 10 %, потрібних для приготування розчину масовою часткою кальцій хлориду 5 %.
25. Визначте маси води і розчину з масовою часткою магній хлориду 20 %, потрібних для приготування розчину масою 300 г з масовою часткою MqCl2 4%
Читайте також:
- Безстатеве розмноження, його визначення та загальна характеристика. Спори — клітини безстатевого розмноження, способи утворення і типи спор.
- Біологічні способи лікування ран.
- Валютний курс і способи його визначення
- Варіанти і способи вимірювань характеристик телефонних каналів
- Види і способи вибіркового спостереження.
- Види конституцій. Класифікація конституцій за соціальними та за юридичними ознаками, за формою вираження, порядком прийняття, за способами внесення змін, часу дії.
- Види середніх величин та способи їх обрахування.
- Види середніх величин та способи їх обрахування.
- Види середніх і способи їх обчислення
- Види та способи гартування.
- Види та способи здійснення посягань на територіальну цілісність.
- Види цивільно-правових договорів в “Руській Правді”, способи їх укладення.
| <== попередня сторінка | | | наступна сторінка ==> |
| Розчини. | | | II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |