
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція № 6
Отже, наведене вище правило Гунда можна сформулювати і так: стійкому стану атома відповідає такий розподіл електронів у межах енергетичного підрівня, за якого абсолютне значення сумарного спіна атома максимальне.
Правило Гунда стверджує, що максимальне значення сумарного спіна атома відповідає стійкому, незбудженому стану, в якому атом має найменшу можливу енергію, але воно не забороняє іншого розподілу електронів в межах підрівня. За будь-якого іншого розподілу електронів енергія атома буде більшою, й атом перебуватиме у збудженому, нестійкому стані.
За правилом Гунда легко скласти схеми електронної будови атомів Нітрогену (Z = 7), Оксигену (Z = 8), Флуору (Z = 9) тощо (тут і далі для спрощення вказуватимемо тільки незавершені енергетичні рівні атомів:
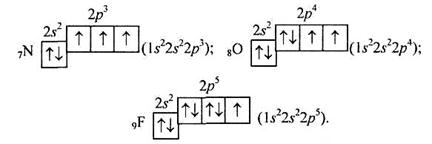 |
В атома Неону (Z = 10) завершується заповнення 2/?-підрівня, а разом з ним і другого енергетичного рівня; електронна формула атома Неону 1s22s22p6.
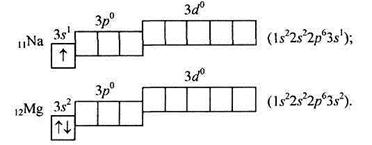 Елементи третього періоду мають три електронні шари. Атоми Натрію (Z = 11) і Магнію (Z = 12), подібно до перших елементів другого періоду (Li,Be), містять у зовнішньому електронному шарі відповідно один або два s-електрони. Схеми електронної будови й електронні формули атомів Натрію і Магнію такі:
Елементи третього періоду мають три електронні шари. Атоми Натрію (Z = 11) і Магнію (Z = 12), подібно до перших елементів другого періоду (Li,Be), містять у зовнішньому електронному шарі відповідно один або два s-електрони. Схеми електронної будови й електронні формули атомів Натрію і Магнію такі:
Починаючи з атома Алюмінію (Z= 13), відбувається заповнення 3p-підрів-ня (електронна формула 1s22s22p63s23pl);у атомів наступних елементів число р-електронів наростає до елемента Аргону, що має протонне число Z= 18:
 |
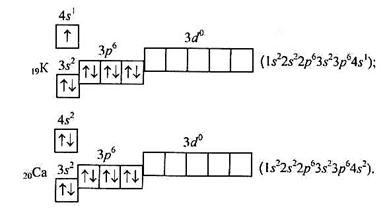 Складніше заповнюються електронні оболонки атомів елементів четвертого періоду — в них є по чотири енергетичних рівні. Атомам Калію і Кальцію передує атом Аргону, у якого повністю заповнені електронами 3s- і 3р-підрівні, але залишилися вільними всі орбіталі 3 d-підрівня. В атомів Калію (Z= 19) і Кальцію (Z = 20) заповнення третього електронного шару тимчасово припиняється і починається заповнення s-підрівня четвертого енергетичного рівня. Електронні формули і схеми електронних структур атомів Калію і Кальцію такі:
Складніше заповнюються електронні оболонки атомів елементів четвертого періоду — в них є по чотири енергетичних рівні. Атомам Калію і Кальцію передує атом Аргону, у якого повністю заповнені електронами 3s- і 3р-підрівні, але залишилися вільними всі орбіталі 3 d-підрівня. В атомів Калію (Z= 19) і Кальцію (Z = 20) заповнення третього електронного шару тимчасово припиняється і починається заповнення s-підрівня четвертого енергетичного рівня. Електронні формули і схеми електронних структур атомів Калію і Кальцію такі:
Пояснити ці електронні формули можна, виходячи з того, що енергія електрона в багатоелектронному атомі визначається величинами не тільки головного, а й орбітального квантових чисел. Електронна будова атомів Калію і Кальцію відповідає першому правилу Клечковського; справді, для 3d-підрівня (п = 3, l = 2) сума п + l дорівнює 5, а для 4s-підрівня (n = 4,l = 0) ця сума дорівнює 4. Отже, енергія 4s-підрівня менша, ніж 3d-підрівня, тому 4s-підрівень повинен заповнюватись раніше. Звідси випливає, що порушення послідовності заповнення електронами електронних орбіталей в атомів елементів четвертого періоду зумовлене енергетичними причинами.
Послідовність заповнення електронами енергетичних підрівнів атомів наступних за Кальцієм елементів, зокрема Скандію (Z = 21), визначається за другим правилом Клечковського. Це пояснюється тим, що енергію електрона більшою мірою визначає не побічне, а головне квантове число. Ось чому спочатку повинен заповнюватись електронами Зіі-підрівень (п = 3, l= 2, п + l=5), а потім 4р-підрівень (п = 4, l= 1, п + l= 5) і електронна формула атома Скандію буде ls22s22p63s23d63d14s2, або [Ar]3d14s2. Далі число електронів на 3d-підрівні наростає аж до остаточного його заповнення в атома Купруму: 22Ті [Ar]3d24s2; 23V[Ar]3d24s2 і т.д. до 29Cu[Ar]3dl04s1; 30Zn[Аr]3d104s2. У решти атомів елементів четвертого періоду електрони заповнюють зовнішній електронний шар включно до елемента № 36 — Криптону:
36Кr 1s22s22p63s23p63 d104s24p6.
Заповнення електронних шарів атомів елементів п'ятого періоду відбувається так само, як і атомів елементів четвертого періоду. Заповнення електронних шарів атомів елементів шостого періоду має свою особливість. Як і в двох попередніх великих періодах, після заповнення електронами зовнішнього електронного шару атомів Цезію і Барію в атомі Лантану починає заповнюватись d-підрівень передостаннього енергетичного рівня, і його електронна формула така: 57La 1s22s22p63s23p63d104s24p64d105s25p65d16s2, або [Xe]5d16s2.Проте в атомах наступних елементів з протонними числами 58—71 (лантаноїдів) з'являються 4f-електрони. В атомі останнього елемента цієї родини четвертий електронний шар досягає повного завершення і стабілізації; електронна формула 71 -го елемента — Лютецію — така:
71Lu 1s22s22p63s23p63d104s24p64dl04f 145s25p65dl6s2.
Заповнення 5d-підрівня, розпочате в атомі Лантану, відновлюється в атомі Гафнію, 72-го елемента, і закінчується в атомі 80-го елемента — Меркурію; у наступних елементів — з 81-го по 86-й — відбувається заповнення 6р-підрівня. Період закінчується інертним елементом Радоном, електронна формула атома якого така: 86Rn 1s22s22p63s23p63d]04s24p64d104f145s25p65d106s26p6.
Структура електронних оболонок атомів елементів сьомого періоду (поки ще незавершеного) має такий самий характер і атомів елементів шостого періоду. На рис. 9 наведено схему послідовності заповнення електронами енергетичних рівнів і підрівнів атомів елементів згідно з правилами Клечковського.
За допомогою електронних формул можна зображувати стан атомів, що перебувають як у збудженому, так і в не-збудженому стані. Так, електронна формула атома Алюмінію, який перебуває в незбудженому стані: 1s22s22p63s23p1, а в збудженому — 1s22s22p63s13p2.

|
Завдання для самоконтролю:
1. У якій групі і в якому періоді періодичної системи елементів Д.І.Менделеєва розміщений елемент з порядковим номером 42?
2. Який елемент ІV періоду періодичної системи Д.І.Менделеєва є найтиповішим металом? Чому?
3. Які сполуки з гідрогеном утворюють елементи головної підгрупи ІV групи? Назвіть найбільш і найменш міцну з них.
4. Напишіть електронну формулу елемента йоду. Вкажіть розподіл електронів по орбіта лях.
5. Скільки електронних рівнів містять атоми елементів з порядковими номерами 15, 29, 51?
6. Електронна формула елемента має таке закінчення …3d54s2? (Хомченко. Збірник задач).
Читайте також:
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вступна лекція
- Вступна лекція 1. Методологічні аспекти технічного регулювання у
- Клітинна селекція рослин.
- Колекція фонограм з голосами осіб, які анонімно повідомляли про загрозу вибуху
- ЛЕКЦІЯ (4): Мануфактурний період світової економіки
- Лекція - Геополітика держави на міжнародній арені
- Лекція 02.04.2013
Переглядів: 4800
| <== попередня сторінка | | | наступна сторінка ==> |
| Електронні конфігурації атомів перших двадцяти елементів періодичної системи Д. І. Менделeєва | | | Тема 2.2. Періодичний закон і періодична система хімічних елементів Д.І.Менделеєва |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |