
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
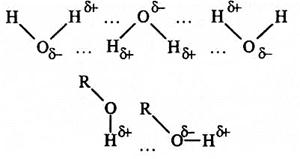
Зв'язок, що утворюється між атомом Гідрогену однієї молекули та атомом сильноелектронегативного елемента (О, S, N, F ma ін.) іншої молекули, називається водневим зв'язком.
Водневий зв'язок
Зв'язок, що утворюється внаслідок взаємодії відносно вільних електронів з іонами металів, називається металічним зв'язкам.
Металічний зв’язок.
Суть процесу утворення металічного зв'язку полягає в наступному: атоми металів легко віддають валентні електрони та перетворюються на позитивно заряджені іони. Відносно вільні електрони, відірвавшись від атомів, усуспільнюються та перемішуються між позитивними іонами металів.
Це так званий електронний газ. Електрони цього газу пересуваються від частинки до частинки, перетворюючи їх на нейтральні частинки, та, вибиваючи електрони, знову переводять їх в іони. Інакше кажучи, в металах відбувається безперервний обмін електронами між атомами. Таким чином виникає металічний зв'язок, тобто електрони належать усім позитивним іонами кристалічної решітки металів.
Висока рухомість електронного газу пояснює такі властивості металів, як тепло- та електропровідність, а відсутність локалізованих хімічних зв'язків — пластичність та ковкість.
Металевий зв'язок приблизно в 3–4 рази слабкіший за одинарний ковалентний зв'язок.
Енергія (міцність) металевого зв'язку зростає зі збільшенням числа валентних електронів і заряду ядра.
Атомний радіус Гідрогену дуже малий, тому під час зміщення або повної віддачі свого єдиного електрона він набуває порівняно високого позитивного заряду. За рахунок цього заряду атом Гідрогену однієї молекули взаємодіє з атомами електронегативних елементів, що мають частковий негативний заряд і входять до складу інших молекул (HF, Н2О, NH3, ROH та ін.).
Водневий зв'язок прийнято позначати крапками. Він більш слабкий, ніж іонний або ковалентний зв'язок, але більш сильний за звичайну міжмолекулярну взаємодію.
Наявність водневих зв'язків пояснює збільшення об'єму води при зниженні температури. Справа в тому, що під час зниження температури відбувається укрупнення молекул, і тому зменшується густина їх «упаковки». Наявність водневих зв'язків пояснює, чому температура кипіння спиртів набагато більша, ніж у вуглеводнів з такою самою довжиною вуглецевого ланцюга.
Водневий зв'язок значно (приблизно у 15—20 разів) слабкіший за ковалентний.
Енергія водневого зв'язку залежить від електронегативності та розміру атома-партнера: чим більша електронегативність та менші розміри цього атома, тим міцніший водневий зв'язок.
Найбільшу міцність має водневий зв'язок між молекулами фтор оводню Н—F...H–F (Е=40 кДж/моль).
 |
Завдання для самоконтролю:
1. Задача. Який з хімічних зв∙язків Н-Сl, H-Br, H-Z, H-S, H-P є найбільш полярним? Укажіть у який бік зміщується електронна густина зв′язку?
2. Задача. Визначте валентність і ступінь окиснення нітрогену в речовинах: а) N2O4, б) (NH4)2CO3, в)NO2
3. Задача. Визначте валентність і ступінь окиснення карбону в сполуках: СН3ОН, НСОН.
4. Визначте, який метал, що виявляє ступінь окиснення +4, утворює оксид з масовою часткою оксисену 40%.
| <== попередня сторінка | | | наступна сторінка ==> |
| Механізм утворення ковалентного зв'язку за рахунок не-поділеної пари електронів одного атома та вільної орбіталі іншого називається донорно-акцепторним. | | | Просторова будова молекул органічних речовин. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |