
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Просторова будова молекул органічних речовин.
Рис. 3.2.4. Схеми гібридизації валентних атомних орбіталей (АО) і напрямленість гібридних орбіталей (q-АО) в просторі утворених молекул
Геометричні конфігурації молекул, що відповідають різним типам гібридизації центрального атома А і вплив зв'язувальних (ЗП) і незв'язувальних (НП) електронних пар на структуру молекул
Просторова будова молекул неорганічних речовин.
Просторова будова молекул неорганічних і органічних речовин.
Тема 3.2. Будова речовин
Лекція № 9
1. Просторова будова молекул неорганічних і органічних речовин.
2. Типи кристалічних решіток і властивості речовин.
Розділ хімії, що вивчає просторову будову молекул та її вплив на хімічні й фізико-хімічні властивості сполук, називають стереохімією. Стійкому стану молекули завжди відповідає саме така геометрична структура, яка має мінімальну потенційну енергію. Оскільки положення атомів у молекулі фіксоване, то сили, що зумовлюють зв'язки в молекулі, не мають всенапрямленості (подібно до сили гравітації), а діють у чітко заданих напрямах. Це є наслідком того, що:
• в об'ємі багатоелектронної системи (атомі чи молекулі) електронний заряд розподілений нерівномірно (не сферично-симетрично);
• найміцніший хімічний зв'язок утворюється там, де в результаті перекривання електронних хвиль атомів, що сполучаються, утворюється найбільша електронна густина.
Відомо, що з усіх атомних орбіталей тільки s-AOмають сферичну симетрію, а інші АО відповідно зорієнтовані в просторі. Отже, геометрія молекули значною мірою залежить від геометрії атомних орбіталей, що беруть участь в утворенні зв'язків.
Назвемо чинники, що визначають і водночас зумовлюють геометрію енергетично стійких молекул.
1. Геометрична конфігурація молекул зумовлюється переважно просторовою напрямленістю ковалентних зв'язків взагалі і σ-зв'язків зокрема.Їх напрямленість, у свою чергу, характеризується кутами зв'язків. Причому π- і σ-зв'язки, як уже зазначалося, утворюються на основі σ -зв'язків, тобто розміщуються в тих самих ділянках між'ядерного простору молекули. Саме такі зв'язки істотно впливають на довжину та енергію (міцність) зв'язку, але їх внесок у значення цих характеристик менший порівняно з σ -зв'язком.
2. Валентний кут молекули є важливою геометричною характеристикою. Це кут між уявними осями, проведеними через ядра хімічно сполучених атомів або між площинами, в яких є два однотипних зв'язки між атомами (табл. 3.2.1.). Валентні кути молекули зумовлюються просторовою орієнтацією відповідних атомних орбіталей неспарених електронів або електронних пар і вакантних орбіталей атомів, які беруть участь в утворенні певної молекули.
 Таблиця 3.2.1.
Таблиця 3.2.1.
Отже, валентні кути молекул своєрідно задаються напрямами вихідних АО, що утворюють кілька одно- чи різнотипних хімічних зв'язків. Наприклад, хімічні зв'язки в молекулах води (Н2О) й аміаку (NH3) підтверджують це положення. Достатньо простежити динаміку утворення σ-зв'язків (відповідно σО–Н і σN–Н рис. 3.2.2.), щоб упевнитися в цьому. Однак реальні валентні кути між σ-зв'язками О—Н у молекулі води і N—Н у молекулі аміаку відрізняються від тих, які можна передбачити на основі аналізу механізму перекривання вихідних АО атомів Оксигену і Нітрогену з атомами Гідрогену.
3. Відхилення реальних валентних кутів молекули від передбачуваних зумовлені такими причинами.По-перше, зв'язки ОН і NH не суто ковалентні і хмари зв'язувальних електронних пар атомів Оксигену та Нітрогену відповідно зміщені в бік Оксигену і Нітрогену.
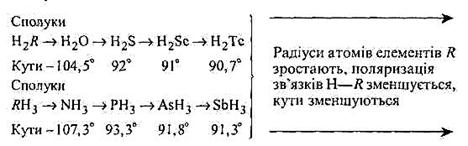 Отже, атоми Оксигену і Нітрогену набувають певного негативного заряду, а атоми Гідрогену (водню) — позитивного, що спричинює їх взаємне відштовхування, внаслідок чого дійсні валентні кути значно відрізняються від теоретично передбачуваних (рис. 3.2.2). Наприклад, кут між двома зв'язками О—Н у молекулі води дорівнює 104,5° (не 90°); кут між кожними з двох зв'язків N—Н молекули аміаку дорівнює 107,3° (не 90°). Проте в рядах сполук, однотипних за формулами з водою і аміаком, кути відповідно дорівнюють:
Отже, атоми Оксигену і Нітрогену набувають певного негативного заряду, а атоми Гідрогену (водню) — позитивного, що спричинює їх взаємне відштовхування, внаслідок чого дійсні валентні кути значно відрізняються від теоретично передбачуваних (рис. 3.2.2). Наприклад, кут між двома зв'язками О—Н у молекулі води дорівнює 104,5° (не 90°); кут між кожними з двох зв'язків N—Н молекули аміаку дорівнює 107,3° (не 90°). Проте в рядах сполук, однотипних за формулами з водою і аміаком, кути відповідно дорівнюють:
Зменшення кутів між відповідними парами однотипних зв'язків пояснюється тим, що розміри атомів елементів, сполучених з Гідрогеном у наведених рядах сполук, зростають, а отже, зменшується поляризація зв'язків «Гідроген — елемент» у відповідних молекулах. Однак сили взаємного відштовхування, як довели теоретичні розрахунки, можуть розштовхувати ці зв'язки лише до кута = 95°. Іншою причиною є участь в утворенні зв'язків не тільки 2р-, а й 2s-електронів атомів Оксигену і Нітрогену. Таке явище «змішування» різних типів валентних АО, наприклад s- і р-, р- і d-АОтощо, називають гібридизацією.
Вихідний стан АО взаємодіючих атомів:
а) Оксигену О+ Гідрогену Н б) Нітрогену N+ Гідрогену Н
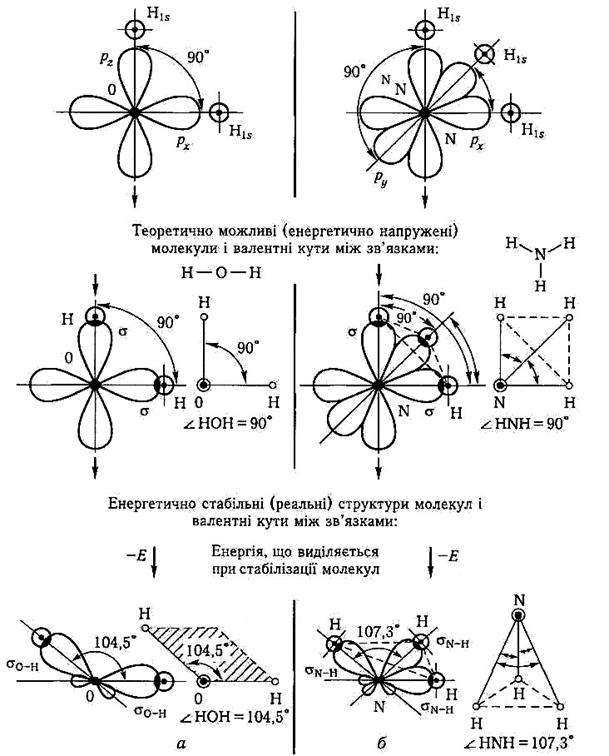 |
Рис. 3.2.2. Динаміка утворення σ- зв’язків (σО–Н і σN–Н) і просторові структури молекул: а-води Н2О; б – аміаку NH3
4. Гібридизація валентних орбіталей — явище, пов'язане з «перебудовою» валентних АО за рахунок збудження атома елемента в момент утворення зв'язків. Кожна з нових АО — це «продукт змішування» збуджених електронів різних типів. Нові електронні АО називають гібридними, причому число їх завжди дорівнює числу вихідних АО.
Гібридні орбіталі, завдяки своїй більшій витягнутості в напрямі зв'язків, повніше й глибше перекриваються з орбіталями атома, з яким зв'язуються. Тому зв'язки утворюються міцніші і досягається більший виграш енергії, чим і пояснюється їх виникнення.
Отже, відповідно до концепції гібридізації, в утворенні ковалентних зв'язків беруть участь не «чисті», а так звані гібридні, тобто усереднені за формою, розмірами та енергією орбіталі, які позначають буквою q (q-AO). Слід зазначити, що явище гібридизації різних за енергією і напрямленістю в просторі АО с реалізацією енергетичної концепції матеріального світу, якій підпорядкована динаміка утворення молекули як структури правильної геометричної будови і мінімальної енергії. Наприклад, при утворенні таких молекул, як хлориди берилію (ВеС12), бору (ВСl3) і карбону (СС14) на основі вихідних s- і р-АО центральних атомів Берилію, Бору і Карбону потрібно було б чекати формування σ-зв'язків, які відрізнялися б як за довжиною, так і за міцністю (за енергією). Однак усі о-зв'язки в наведених молекулах (два зв'язки Be—Сl, три В—Сl і чотири С—Сl) виявляються рівноцінними як за енергією, так і за валентними кутами, тобто зв'язки розміщуються симетрично один відносно одного (рис. 3.2.3).
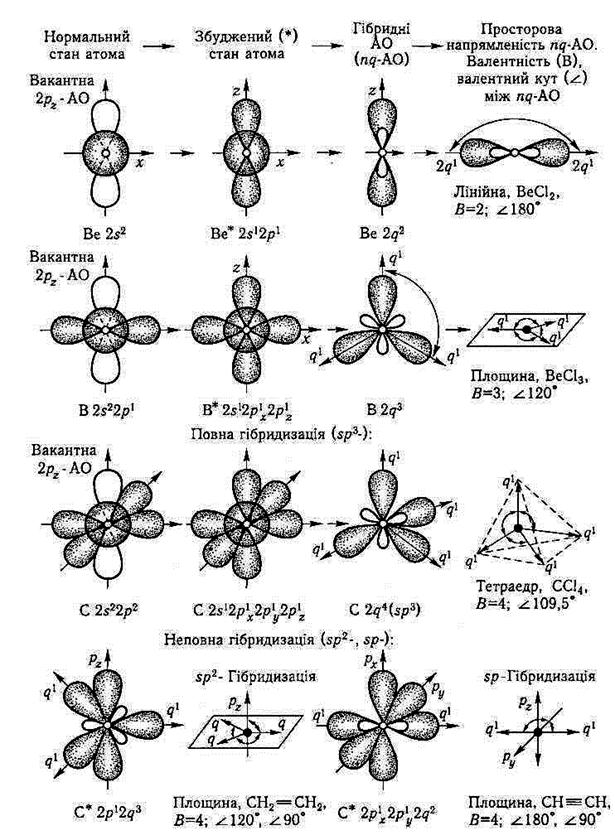 |
Рис. 3.2.3. Динаміка формування просторової структури молекул, утворених елементами другого періоду періодичної системи – Берилієм Ве, Бором В, Карбоном С (три типи гібридизації)
5. Деякі необхідні умови гібридизації, що забезпечують утворення найстійкішої структури молекули:
• у гібридизації можуть брати участь АО з близькими значеннями енергій, тобто s- і р-АО зовнішнього рівня, d-АО зовнішнього або попереднього рівня. При цьому йдеться про певні типи гібридизації, наприклад про sp-, sp2-, sp3 -чи sp3d2 – гібридизацію. Для розуміння того, якою має бути форма гібридної АО, досить розглянути рис. 3.2.4, де подано схеми механізму sp-, sp2-, sp3-гібридизації як результат «змі шування» s-АО відповідно з однією, двома чи трьома р-АО. Оскільки р-орбіталь по різні боки від початку координат має різні знаки амплітуди (+ чи –) і знак з одного боку збігається зі знаком s-AO, то в результаті додавання s- і р-АО густина електронної пари по один бік від ядра буде більшою, а по другий — меншою, що видно зі схеми на рис. 3.2.4, а (утворення двох симетрично розміщених на одній осі непропорційно-однобічних гантелей).
Отже, таку саму форму матимуть три гібридні АО, які утворюються у разі іншого типу гібридизації — sp2-гібридизації, причому вони розміщуються в площині під кутом 120° (див. рис. 3.2.4, б). На рис. 3.2.4, в зображено ще один тип гібридизації — sp3-гібридизація, в якій беруть участь чотири вихідних АО. Вони утворюють чотири гібридні q-AO, що розміщуються в просторі симетрично як чотири осі тетраедра з валентним кутом 109°28';
• як бачимо (див. рис. 3.2.4) гібридні АО (q-AO) є більш витягнутими в просторі атома і розміщуються симетрично на тих осях, що забезпечують їм повніше (тобто енергетично ефективніше) перекривання з АО сусідніх атомів, з якими утворюються хімічні зв'язки;
• у гібридизації беруть участь АО з достатньо високою електронною густиною ( ). Здебільшого таку густину мають АО елементів початкових періодів;
). Здебільшого таку густину мають АО елементів початкових періодів;
• кількість гібридних орбіталей (q-AO)зв'язувальних (ЗП) і незв'язувальних (НП) пар електронів дорівнює кількості вихідних АО, що беруть участь у гібридизації. Проте не всі гібридні АО утворюють хімічні зв'язки, певна кількість їх залишається вільними,тобто незв'язувальпими електронними парами (НП).
 |
Співвідношення між числом зв'язувальних (ЗП) і незв'язу вальних (НП) пар електронів пов'язане зі структурою однотипних молекул АВп (АВ2 чи АВ3, АВ4 тощо). Кількість утворених атомів А і В (де А — один центральний атом, а В — атоми, які сполучаються з центральним) зв'язувальних МО не завжди збігається за кількістю з утворюваними центральним атомом А гібридними q-AO. Наприклад, молекули на зразок АВ2 можуть мати три типи гібридизації центрального атома А (див. табл. 3.2.1):
• sp-, і тоді кількість q-AO –- 2, молекула матиме тільки дві зв'язувальні
МО і лінійну структуру, наприклад, як у молекулі ВеС12;
• sp2 -, q-AO = 3, дві ЗП та одну НП (вільну пару), кутова площинна
будова, наприклад, як у молекулі SnCl2;
в) sp3-, q-AO = 4, дві ЗП та дві НП, кутова площинна структура молекули,
наприклад, як у молекулі Н2О.
Отже, тип гібридизації центрального атома впливає на геометричну конфігурацію молекул за умови одного й того самого складу молекул.
7. Просторова орієнтація гібридних орбіталей (q-A О) в атомі має забезпечити їх максимальну взаємну віддаленість і, отже, мінімум енергії їх відштовхування та мінімум енергії всієї молекули. Зауважимо, що просто рова напрямленість гібридних q -АО визначає і зумовлює геометричну будову всієї молекули (див. рис. 3.2.4 і табл. 3.2.1). Як бачимо, дві sp-гібридні АО на зразок ВеС12 (у загальному вигляді АВ2) та три sp2-гібридні АО розміщуються симетрично на площині атомів. При цьому утворюються інійні молекули (збільшення числа НП центрального атома) під кутами 120°С, унаслідок чого утворюються молекули площинної будови двох типів: з трьома ЗП; з двома ЗП та однією НП (див. табл. 3.2.1).
Чотири sp3-гібридні що розміщуються в напрямі осей такої правильної геометричної структури, як тетраедр, де в центрі його знаходиться центральний атом А, а у вершинах — атоми В. Очевидно, що за умови такої гібридизації можливі три типи молекул: АВ4 (СН4,СС14) тетраедричної структури, де всі зв'язки зв'язувальні (ЗП); АВ3 (NH3,NF3) пірамідальної структури, де є три ЗП та одна НП; АВ2 (Н2О) площинної будови, де є дві ЗП та дві НП (див. табл.3.2.1). Динаміку формування просторової структури (геометрії) молекул, утворюваних елементами другого періоду періодичної системи, зображено на рис. 3.2.3.
8. Причини відхилень валентних кутів, зумовлених певним типом гібридизації, від реальних кутів між хімічними зв 'язками:
• вплив електронних пар незв'язувальних (або неподілених) АО на структуру молекул пояснюється відштовхувальною дією НП на сусідні ЗП, оскільки електронна густина ЗП на молекулярній орбіталі є більшою порівняно з густиною НП. Тому ЗП займають менший між'ядерний простір порівняно з електронною хмарою НП (рис. 3.2.4). За ступенем взаємного відштовхування електронні пари можна розмістити в такий ряд:
НП — НП > НП — ЗП > ЗП — ЗП.
 Зменшення кута зв'язку в ряду молекул: СН4 (НП відсутні), NH3 (одна НП), Н2О (дві НП) за умови одного типу гібридизації (тобто sp3 з тетраедричним розміщенням чотирьох q-АО) пояснюється збільшенням числа НП центрального атома, відповідно Карбону, Нітрогену, Оксигену (див. рис. 7.2.5):
Зменшення кута зв'язку в ряду молекул: СН4 (НП відсутні), NH3 (одна НП), Н2О (дві НП) за умови одного типу гібридизації (тобто sp3 з тетраедричним розміщенням чотирьох q-АО) пояснюється збільшенням числа НП центрального атома, відповідно Карбону, Нітрогену, Оксигену (див. рис. 7.2.5):
• вплив електроиегативності атома-партнера центрального атома молекули на величину валентних кутівзводиться до такої залежності: чим більш електронегативним є такий атом, тим менше простору потребує він біля центрального атома для розміщення зв'язувальної електронної пари (ЗП) внаслідок більшого зміщення її у бік такого партнера і тим менше виявляється ефект відштовхування між сусідніми ЗП. Так, в однотипних молекулах NH3 і NF3 з однаковим типом гібридизації Нітрогену кут зв'язку ZFNF (102°) є меншим, ніж кут зв'язку ZHNH (107,3°);
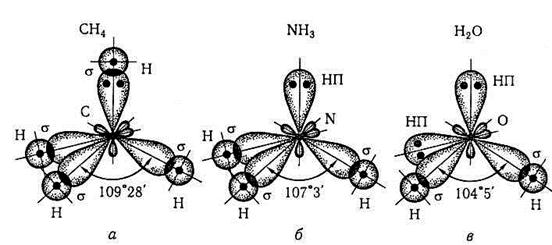
Рис. 3.2.5. Вплив незв'язувальних пар електронів (НП) на величини валентних кутів у молекулярних структурах з гібридизацією центральних атомів (sp3 -, C, N, О), де зв'язувальні пари електронів (ЗП) утворюють σ-зв'язки з атомами Гідрогену Н: a — чотири σ -зв'язки під кутом 109°28' (відсутні НП); б — три σ -зв'язки під кутом 107°3' (одна НП);е — два σ -зв'язки під кутом 104°5' (дві НП)
• вплив кратності (порядку) зв'язку на значення валентних кутів молекулзумовлюється тим, що електронна хмара подвійного чи потрійного зв'язку займає більший міжатомний простір порівняно з одинарним (простим) σ-зв'язком, тому чинить більшу відштовхувальну дію, що призводить до збільшення кутів між зв'язками, з яких хоча б один є кратним. Наприклад, у молекулі COF2, яка має площинну будову, кут зв'язку  F — С = О, що дорівнює 126°, є більшим за кут зв'язку
F — С = О, що дорівнює 126°, є більшим за кут зв'язку  F — C —F (108°).
F — C —F (108°).
Стереохімія вивчає просторову будову органічних сполук. Її можна назвати хімією з'єднань в тривимірному просторі. Просторова будова взаємозв'язана не тільки з фізичними і хімічними властивостями речовин, але і з біологічною активністю, що проявляється ними.
Читайте також:
- II. Будова доменної печі (ДП) і її робота
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Аваріїз витоком сильнодіючих отруйних речовин.
- Активний транспорт речовин. Дослід Уссінга
- Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями.
- Алкіни – вуглеводні, в молекулах яких є два атоми вуглецю, сполучені потрійним зв’язком - -. Алкіни називають також ацетиленовими вуглеводнями.
- Анатомічна будова кісток вільної нижньої кінцівки
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка та її вплив на його психологічні особливості й поведінку.
- Антигенна будова HDV
- АСОЦІАЦІЯ. ПОБУДОВА АСОЦІАТИВНОГО КУЩА
| <== попередня сторінка | | | наступна сторінка ==> |
| Зв'язок, що утворюється між атомом Гідрогену однієї молекули та атомом сильноелектронегативного елемента (О, S, N, F ma ін.) іншої молекули, називається водневим зв'язком. | | | Поняття про будову |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |