
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Під швидкістю хімічної реакції розуміють зміну концентрації однієї з реагуючих речовин за одиницю часу за незмінного об'єму системи.
При цьому немає значення, про яку з речовин, що бере участь у реакції, йдеться: всі вони пов'язані між собою рівнянням реакції, і за зміною концентрації однієї з речовин можна судити про відносні зміни концентрацій решти речовин» Звичайно концентрацію виражають в моль/л, а час — у секундах або хвилинах. Якщо, наприклад, вихідна концентрація однієї з речовин, що взаємодіють, становила 1 моль/л, а через 4 с від початку реакції вона становить 0,6 моль/л, то середня швидкість реакції дорівнює (1 — 0,6)/4 = 0,1 моль/(л ∙с).
 Розглянемо в загальному вигляді швидкість реакції, що відбувається за рівнянням: А + В = С + D
Розглянемо в загальному вигляді швидкість реакції, що відбувається за рівнянням: А + В = С + D
|
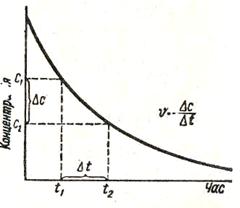
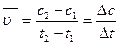 В міру витрачання речовини А швидкість реакції зменшується (як це показано на рис.4.3.1). Звідси випливає, що швидкість реакції можна визначити лише для деякого проміжку часу. Оскільки концентрація речовини А в момент часу t1 вимірюється величиною с1, а в мо-мент t2 — величиною с2, то за промі-жок часу
В міру витрачання речовини А швидкість реакції зменшується (як це показано на рис.4.3.1). Звідси випливає, що швидкість реакції можна визначити лише для деякого проміжку часу. Оскільки концентрація речовини А в момент часу t1 вимірюється величиною с1, а в мо-мент t2 — величиною с2, то за промі-жок часу 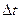 = t2 – t1зміна концентрації речовин становитиме ∆с = c2 – c1 звідки можна визначити се– cередню швид-кість реакції (υ):
= t2 – t1зміна концентрації речовин становитиме ∆с = c2 – c1 звідки можна визначити се– cередню швид-кість реакції (υ):
.
Знак "мінус" ставимо тому, що, незважаючи на зменшення концентрації речовини А і, отже, на від'ємне значення різниці с2 – c1, швидкість реакції може бути тільки додатною величиною. Можна також стежити за зміною концентрації одного з продуктів реакції — речовин С або D; вона під час реакції збільшуватиметься, і тому в правій частині рівняння треба ставити знак "плюс".
Оскільки швидкість реакції весь час змінюється, то в хімічній кінетиці розглядають тільки дійсну швидкість реакціїυ, тобто швидкість у даний момент часу.
Хімічна рівновага - це такий стан системи, коли швидкість прямої реакції дорівнює швидкості оборотної реакції Vпр = Vзв.
Константа хімічної рівноваги не залежить від концентрації реагуючих речовин, а залежить лише від температури:
К = 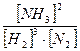
Вплив зовнішніх умов на хімічну рівновагу.
Принцип Ле-Шательє. Якщо на врівноважену систему діяти ззовні (температура, тиск, концентрація), то рівновага зміщується у напрямку тієї реакції, яка протидіє цій зміні.
Приклади: 3Н2 + N2  2NH3 + Q
2NH3 + Q
 3V + 1V 2V
3V + 1V 2V
1) Якщо пряма реакція екзотермічна, то для підви-
щення виходу продукту систему треба охолоджувати.
 |
2) Якщо пряма реакція супроводжується зменшен-
ням об'єму, то для підвищення виходу продукту сис-
тему треба стискати (підвищувати тиск).
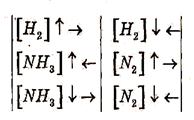 |
3) Якщо у врівноважену систему додати реагентів,
то рівновага зміститься у напрямку утворення
продуктів.
4) Каталізатор прискорює обидві реакції - і пряму, і оборотну, - тому на хімічне рівновагу оборотних реакцій не впливає.
| <== попередня сторінка | | | наступна сторінка ==> |
| Швидкість хімічних реакцій | | | Сам каталізатор у реакціях не витрачається і до складу кінцевих продуктів реакції не входить. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |