
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Сам каталізатор у реакціях не витрачається і до складу кінцевих продуктів реакції не входить.
Хімічні реакції, що відбуваються за участю каталізаторів, називаються каталітичними.
Каталіз.
Каталітичний вплив можна чинити на більшість хімічних реакцій. Кількість каталізаторів дуже велика, а їх каталітична активність досить різна. Вона визначається зміною швидкості реакції, спричиненою каталізатором»
Розрізняють два види каталізу — гомогенний(однорідний) і гетерогенний (неоднорідний) каталіз.
При гомогенному каталізі реагуючі речовини і каталізатор утворюють однофазну систему — газувату або рідку, між каталізатором і речовинами, що реагують, немає поверхні поділу. Наприклад, каталітичний розклад пероксиду гідрогену за наявності розчину солей (рідка фаза). Для гомогенного каталізу встановлено, що швидкість хімічної реакції пропорційна концентрації каталізатора.
При гетерогенному каталізі реагуючі речовини і каталізатор утворюють систему з різних фаз. У цьому разі між каталізатором і реагуючими речовинами існує поверхня поділу. Звичайно каталізатор — тверда речовина, а реагуючі речовини — гази або рідини. Прикладами можуть бути окиснення аміаку (газувата фаза) за наявності платини (тверда фаза) або розклад пероксиду гідрогену (рідка фаза) за наявності вугілля або оксиду мангану(ІV) (тверда фаза). Всі реакції при гетерогенному каталізі відбуваються на поверхні каталізатора. Тому активність твердого каталізатора – залежить і від властивостей його поверхні (розміру, хімічного складу, будови іі стану).
Дія позитивних каталізаторів зводиться де зменшення енергії активації реакції, іншими словами, — до зменшення висоти енергетичного бар'єра. При цьому утворюється активований комплекс з нижчим рівнем енергії, й швидкість реакції сильно зростає.
Механізм дії каталізаторів звичайно пояснюють утворенням проміжних сполук з однією з реагуючих речовин. Так, якщо реакцію А + В = АВ, що відбувається повільно, проводити за наявності каталізатора К, то каталізатор вступатиме в хімічну взаємодію з однією з вихідних речовин з утворенням неміцної проміжної сполуки:
А + К = АК ,
Реакція відбувається швидко, оскільки енергія активації цього процесу мала. Потім проміжна сполука АК взаємодіє з іншою вихідною речовиною, при цьому каталізатор вивільнюється:
АК + В = АВ+ К.
Енергія активації цього процесу також мала, тому реакція відбувається з достатньою швидкістю. Якщо тепер обидва процеси, що плинуть одночасно, додати, то дістанемо остаточне рівняння реакції, що швидко відбувається:
А + В = АВ.
Наведемо конкретний приклад — окиснення SО2 до SO3 за участю каталізатора NO:
SO2 + 1/2 О2 - SОз;
А + В = АВ,
Ця реакція перебігає повільно. Проте при додаванні каталізатора утворюється проміжна сполука:
NO + 1/2 О2 = NO2;
K+В = КВ
І далі
SO2 + NO2 = SО3 + NO;
А + КВ = АВ + К.
Поверхня каталізатора неоднорідна. На ній є так звані ативні центри, на яких в основному і відбуваються каталітичні реакції. Реагуючі речовини адсорбуються на цих центрах, внаслідок чого збільшується концентрація їх на поверхні каталізатора, А це частково зумовлює прискорення реакції. Однак головною причиною зростання швидкості реакції є значне підвищення .хімічної активності адсорбованих молекул. Під дією каталізатора послаблюються зв'язки між атомами в адсорбованих молекулах, і вони стають більш реакційноздатними. І в цьому разі реакція прискорюється внаслідок зниження енергії активації (в тому числі і через утворення поверхневих проміжних сполук).
Деякі речовини знижують або й повністю знищують активність твердого каталізатора. Такі речовини називаються каталітичними отрутами.Як приклад можна навести сполуки арсену, меркурію, плюмбуму, ціанисті сполуки, до яких особливо чутливі платинові каталізатори. У виробничих умовах реагуючі речовини очищають від каталітичних отрут, а вже отруєні каталізатори регенерують.
Однак існують і такі речовини, що підсилюють дію каталізаторів даної реакції, хоча самі не є каталізаторами. Ці речовини називаються промоторами(промотування платинових каталізаторів домішками заліза, алюмінію тощо). Слід особливо відзначити, що дія каталізаторів вибірна, тому, застосовуючи різні каталізатори, можна з однієї і тієї самої речовини добути різні продукти. Наприклад, за наявності каталізатора оксиду алюмінію Аl2О3 при 300o С з етилового спирту добувають воду й етилен:
С2Н5ОН → Н2О + С2Н4.
За цієї самої температури, але за наявності дуже подрібненої міді з етилового спирту утворюються водень і оцтовий альдегід:
O
//
С2Н5ОН→ Н2 + СН3 — C
\
H
Досвід показує, що для кожної реакції існує оптимальний каталізатор.
Каталізатори у хімічному виробництві відіграють виняткову роль. Добування сульфатної кислоти, синтез аміаку, добування з твердого вугілля рідкого палива, переробка нафти й природного газу, добування штучного каучуку, пластмас, гідрогенізація жирів — ось далеко не повний перелік найважливіших виробництв, де застосовуються каталізатори.
Очевидно, пошуки нових, досконаліших каталізаторів сприятимуть підвищенню продуктивності праці й зниженню собівартості продукції.
Особливу роль відіграють, біологічні каталізатори — ферменти.За їх участю відбуваються складні хімічні процеси в рослинних і тваринних організмах.
Завдання для самоперевірки:
1. На скільки градусів треба збільшити температуру, щоб швидкість реакції зросла в 27 разів? Температурний коефіцієнт швидкості реакції становить 3.
2. За певних умов реакція хлороводню з киснем є оборотною:
4НСl( )+O2(г)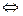 2Cl(г)+2H2O(г), ∆Ho=–116,4кДж
2Cl(г)+2H2O(г), ∆Ho=–116,4кДж
Як на рівноважний стан системи впливає: а) підвищення тиску; б) підви-щення температури; г) введення каталізатора?
3. Як вплине зниження тиску на рівновагу в реакціях:
а) N2O4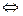 2NO2
2NO2
б) 2NO+O2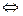 2NO2
2NO2
в) 3FeO3(к)+CO(г) 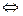 2 Fe3O4(к)+ CO2 (г)
2 Fe3O4(к)+ CO2 (г)
Тестові завдання по темі «Електролітична дисоціація»
| № з/п | Питання | Відповіді | |||
| 6.1.1. Укажіть правильне закінчення речення: «Речовини, що виявляють у розчинах властивості сильних електролітів, складаються ...». | тільки з іонів | тільки з молекул | з іонів, а інколи з молекул | із молекул, а інколи з іонів | |
| 6.1.2. Укажіть, які речовини у розплавленому (рідкому) стані є сильними електролітами: | основи та кислоти | луги та солі | основи, кислоти та амфотерні гідроксиди | кислоти та солі | |
| 6.1.3. Речовини, що у процесі дисоціації утворюють аніони одного типу — гідроксид-іони, називають: | середніми (нормальними) солями | кислотами | основами | основними солями | |
| 6.1.4. Речовини, що у процесі дисоціації утворюють катіони одного типу — йони Гідрогену, називають: | солями | кислотами | лугами | амфотерними гідроксидами | |
| 6.1.5.Трьома стадіями проходить електролітична дисоціація: | алюміній хлориду | алюміній гідроксиду | калій ортофосфату | ортофосфатної кислоти | |
| 6.1.6.Двома стадіями проходить електролітична дисоціація: | кальцій хлориду | натрій гідроксиду | калій ортофосфату | сульфатної кислоти | |
6.1.7.Речовина, у процесі дисоціації якої утворюються катіони К+ та Н+, а також аніони CO , є: , є:
| кислотою | лугом | середньої сіллю | кислою сіллю | |
| 6.1.8.Укажіть формули речовин, які в водному розчині дисоціюють ступінчасто: | FeCl3 | КН2РО4 | NaHCO3 | КОН | |
| 6.1.9.З утворенням як катіонів тільки катіонів металу в водному розчині дисоціюють: | середні солі | кислі солі | солі амонію | амфотерні гідроксиди | |
| 6.1.10. Речовина, у процесі дисоціації якої утворились катіони натрію та хлорид-іони, належить до: | середніх солей | кислот | кислих солей | лугів | |
6.1.11. Речовина, у процесі дисоціації якої утворились іони Na+, H+, CO , належать до : , належать до :
| середніх солей | кислот | кислих солей | лугів | |
| 6.1.12. Укажіть пари іонів, які не можуть сумісно перебувати у водному розчині в значних кількостях |
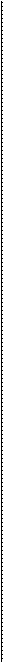    H+ та ОН- H+ та ОН-
| Ag+ та NО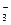
| Са2+ та РО
| Ва2+ та CO
| |
| 6.1.13. Сумісно з якими аніонами у водному розчині в значних кількостях може перебувати катіон Ва2+ ? | СІ- | NО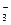
| SO
| СО
| |
| 6.1.14. Укажіть, у якій з наведених нижче йонних схем виділяється газ: | Н+ + ОН- → |
2Н+ + СО → →
|
2H++SO → →
|
Са2++ СО → →
| |
  6.1.15. Скорочене йонне рівняння Си2++2ОН - Сu (ОН)2
відповідає взаємодії: 6.1.15. Скорочене йонне рівняння Си2++2ОН - Сu (ОН)2
відповідає взаємодії:
| CuSO4 та NaOH | CuS та NaOH | CuSO4 та А1(ОН)3 | СиС12 та NaOH | |
6.1.16.Скорочене йонне рівняння
  Ва2+ +SO Ва2+ +SO BaSO4 відповідає взаємодії: BaSO4 відповідає взаємодії:
| BaO та H2SO4 | ВаС12 та H2SO4 | ВаС12 та PbSO4 | Ва (NO3)2 та Na 2SO4 | |
| 6.1.17.Укажіть пару електролітів, реакція між якими у водному розчині неможлива: | Na2S та HCl | К2СО3 та H2SO4 | NaBr та KOH | Fe(NO3)2 та NaOH | |
 6.l. l8. Укажіть, взаємодії яких речовин відповідає скорочене йонне рівняння Н+ + ОН- Н2О: 6.l. l8. Укажіть, взаємодії яких речовин відповідає скорочене йонне рівняння Н+ + ОН- Н2О:
| калій гідроксиду та силікатної кислоти | натрій гідроксиду та сульфідної кислоти | алюміній гідроксиду та хлоридної кислоти | ферум(П) гідроксиду та карбонатної кислоти | |
| 5.1.19. Установіть відповідність між реагентами та скороченими іонними рівняннями реакцій: Реагенти а) Na2S та НС1; б) ВаС12 та Na2SO4; в) К2СО3 та H2SO4; г) CuSO4 та NaOH. | Рівняння Сu2++2ОH - → Cu(OH)2↓ | Рівняння
2Н+ + CO → СО2 ↑ +Н2О → СО2 ↑ +Н2О
| Рівняння 2Н+ + S2- → H2S↑ | Рівняння
Ва2+ + SO → BaSO4↓ → BaSO4↓
| |
| 6.1.20. Установіть відповідність між реагентами та скороченими йонними рівняннями реакцій: Реагенти а) Ba(NO3 )2 та H2SO4 б) ВаС12 та Na2CO3 в) Zn(OH)2 та НС1; г) CuSO4 та Na2S. | Рівняння Cu2+ +S2-→ CuS ↓ | Рівняння Zn(OH)2 +2H+ → Zn2+ +2H2O |
Рівняння
Ва2+ + CO →ВаСО3↓ →ВаСО3↓
|
Рівняння
Ва2+ +SО →BaSO4↓ →BaSO4↓
|
Вправи по темі “ Електролітична дисоціація „
1. Складіть рівняння повної електролітичної дисоціації сполук (табл. 1)
Таблиця 1
| Варіант | Сполуки | Варіант | Сполуки |
| H2SO4, NaOH, Pb(NO3)2 | H2CO3, KOH, Na2SO3 | ||
| HNO3, Ba(OH)2, NaHCO3 | HCl, Ba(OH)2, NaHS | ||
| H2SO3, KOH, Cr2(SO4)3 | H2SO4, Ba(OH)2, NaHS | ||
| HCl, NaOH, NaHSO4 | HNO2, KOH, Na2HPO4 | ||
| H2S, NaOH, Na2CO3 | H2CO3, NaOH, CuSO4 | ||
| HBr, Ba(OH)2, NaHSO4 | H2SO4, Ba(OH)2, Al2(SO4)3 | ||
| HNO3, NaOH, KHCO3 | HBr, KOH, NaH2PO4 | ||
| H2S, KOH, Fe2(SO4)3 | HNO2, Ba(OH)2, K2HPO4 |
2. Складіть молекулярні, повні та скорочені іонні рівняння реакцій, які відповідають таким схемам (табл. 2)
Таблиця 2
| Варіант | Сполуки | Варіант | Сполуки |
| NaOH+CuSO4→ HNO3+Ca(OH)2→ | NaOH+CuCl2→ H2SO4+Zn(OH)2→ | ||
| KOH+MqCl2→ HBr+Cu(OH)2 | KOH+NiCl2→ HCl+Cu(OH)2→ | ||
| NaOH+HCl→ BaCl2+H2SO4→ | KOH+Al2(SO4)3→ HNO3+NaOH→ | ||
| KOH+AlCl3→ HBr+Zn(OH)2→ | KOH+HCl→ Na2S+Pb(NO3)2→ | ||
| KOH+HCl→ BaCl2+AqNO3→ | KOH+HNO3→ HCl+Na2CO3→ | ||
| NaOH+H2SO4→ BaCl2+K2SO4→ | NaOH+FeCl3→ HBr+Mn(OH)2→ | ||
| KOH+FeCl3→ H2SO4+Zn(OH)2→ | KOH+H2SO4→ HCl+Na2SO3→ | ||
| NaOH+SnCl2→ HCl+Zn(OH)2→ | KOH+H3PO4→ NaCl+AqNO3→ |
3. Складіть молекулярні рівняння реакцій, які відповідають таким скороченим іонним рівнянням (табл. 3).
Табл. 3
Таблиця 2
| Варіант | Скорочені іонні рівняння | Варіант | Скорочені іонні рівняння |
| SiO32-+2H+→ H2SiO3↓Fe2++2OH-→ Fe(OH)2↓ | H++OH-→H2OBa2++SiO32-→ BaSiO3↓ | ||
| Aq++Cl-→AqCl↓H++OH-→H2O | Zn2++2OH-→Zn(OH)2↓ Mq2+ +CO32-→MqCO3↓ | ||
Mn2++2OH-→Mn(OH)2↓
Co2+S2-→CoS↓
| Ca2++CO32-→CaCO3 ↓Cr3++3OH- →Cr(OH)3↓ | ||
| Ba2++SO42-→BaSO4↓ Ni2++2OH-→Ni(OH)2↓ | NH4++OH-→NH3↑+H2OMn2++S2-→MnS↓ | ||
| 2H++CO32-→CO2↑+H2OSn2++2OH-→Sn(OH)2↓ | Fe2++2OH-→Fe(OH)2↓2H++SO32-→SO2↑+H2O | ||
| Cu2++2OH-→Cu(OH)2↓ Aq++Br-→AqBr↓ | Mq2++2OH-→Mq(OH)2↓ Cu2++S2-→CuS↓ | ||
| Fe3++3OH-→Fe(OH)3↓Al3++PO43-→AlPO4↓ | Ca2++2OH-→Ca(OH)2↓Ba2++SO42-→ BaSO4 ↓ | ||
| Pb2++S2-→PbS↓H++OH-→H2O | Al3++3OH-→Al(OH)3↓Aq++I-→AqI↓ |
Читайте також:
- V. За участю каталізатора
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналіз процесу і продуктів діяльності.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- Баланс основних продуктів харчування в Україні, тис. т
- Біогенні аміни та реакції декарбоксилювання
- Біологічна безпека харчової сировини і продуктів
- Біологічні каталізатори – ферменти
- Види опор та їх реакції
| <== попередня сторінка | | | наступна сторінка ==> |
| Під швидкістю хімічної реакції розуміють зміну концентрації однієї з реагуючих речовин за одиницю часу за незмінного об'єму системи. | | | Загальні способи добування металів. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |