
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Біологічні каталізатори – ферменти
Їх особливості:
1. Висока ефективність. Ферменти діють в 103-106 разів ефективніше, ніж не біологічні каталізатори.
2. Вибірковість. Певний фермент при даних умовах каталізує тільки одну біологічну реакцію.
3. Ферменти діють при м’яких умовах проходження біохімічних процесів (t0, р, рН).
4. Швидкість біохімічних процесів залежить як від концентрації реагуючих речовин (субстрата-S), так і від концентрації фермента - Е
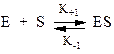

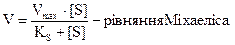
не враховує вплив концентрацій продуктів реакції на швидкість реакції.
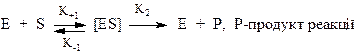
К+1 - константа швидкості утворення комплекса;
К-1 - константа швидкості розпаду комплексу;
К - константа швидкості переходу комплекса в продукт реакції фермент.
Враховуючи К2 і Е, можна записати вираз для стаціонарної швидкості:
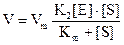 ; де Кm - константа Міхаеліса, яка дорівнює:
; де Кm - константа Міхаеліса, яка дорівнює:
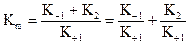 , і знаходиться експериментально.
, і знаходиться експериментально.
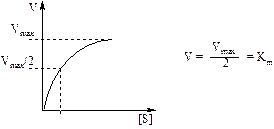
Приведене рівняння для швидкості є рівнянням Міхаеліса-Ментена. Добуток К·[Е] має розмірність швидкості реакції, яку називають швидкістю ферментативної реакції і позначають Vm (Vm - швидкість, з якою проходить реакція, якщо фермент перебуває у складі комплексу [ЕS]. Тобто Vm.= К2[Е]. Тоді рівняння Міхаеліса-Ментена запишеться так:
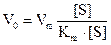
Таким чином, при [S] >>[Е] стаціонарна швидкість ферментативної реакції має гіперболічну залежність від концентрації субстрату і лінійну від початкової концентрації ферменту (див.рисунок).
Ці залежності дійсно характеризують кінетику більшості ферментативних реакцій.
Рівняння Міхаеліса-Ментена має два граничних випадки:
коли [S] << Кm, то швидкість описується рівнянням першого порядку відносно [S].
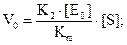
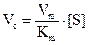
Коли [S] >> Кm, то швидкість має нульовий порядок відносно [S]:
V0 = К2·[Е0] = Vmах;
Константу К2 в рівнянні Vm = К2·[Е] називають числом обертів ферменту. Число обертів - це кількість молекул субстрату, які перетворюються у продукт реакції за умови, що весь фермент знаходиться у складі фермент-субстратного комплексу. Число обертів більшості ферментів становить 0,5 – 104 с-1 .
Значення Кm наводять поряд із Vm і К2, як кількісний параметр ферментативної реакції, то величина Кm залежить від рН, температури, природи субстрату та інших факторів. Найчастіше її значення знаходиться у межах 10-1 – 10-6м/сек. Значення Vm використовується для характеристики кількості або активності ферменту.
Читайте також:
- Біологічні і психологічні теорії.
- Біологічні методи боротьби з шкідниками сільського й лісового господарства
- БІОЛОГІЧНІ МОТИВАЦІЇ
- Біологічні мутагени
- Біологічні мутагени.
- Біологічні небезпеки
- Біологічні небезпеки
- Біологічні небезпеки
- Біологічні небезпеки
- Біологічні небезпеки
- Біологічні небезпеки.
| <== попередня сторінка | | | наступна сторінка ==> |
| Каталітичні процеси. | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |