
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Гідроліз.
Вода є слабким електролітом, що дисоціює за рівнянням:
Н2О = Н+ + ОН–.
Іонним добутком (Кв) води називається добуток рівноважних концентрацій іонів Н+ і ОН–, який є постійною величиною, що дорівнює 10-14.
Кв = [Н+ ] × [ОН– ] = 10-14.
Для характеристики реакції середовища доцільно користуватися водневим показником
рН = –lg [H+].
В нейтральному середовищі рН = 7, в кислому рН < 7, в лужному середовищі рН > 7.
Приклад 26.
Розрахуйте рН 0,1 М розчину КОН.
Розв'язання.
Гідроксид калію є сильним електролітом, тому концентрація іонів ОН– дорівнює 0,1 моль/л.
Запишем вираз для іонного добутку Кі = [H+] [OH–] = 10–14. Звідси:
[H+] = Кі / [OH–] = 10–14 / 0,1 = 10–13.
рН = – lg [H+] = – lg 10–13 = 13.
Приклад 27.
Розрахуйте рН 0,1 М розчину CH3COOH , якщо відомо, що константа дисоціації CH3COOH дорівнює 1,7 10–5..
Розв'язання.
Ацетатна (оцтова) кислота є слабким електролітом. Для розрахунків концентрацій іонів використуємо рівняння Освальда:
К = a2С, 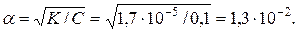
Концентрація іонів гідрогену буде:
[H+] = a C = 1,3 10-2 0,1 = 1,3 10-3.
рН = – lg [H+] = – lg 1,3 10–3 = 2.89.
Гідролізом солей називається обмінна реакція взаємодії іонів розчиненої солі з водою, в результаті якої утворюються малодисоційовані сполуки та змінюється рН середовища.
Більшість солей є сильними електролітами, вони дисоціюють на катіони металів та аніони кислотних залишків. Якщо катіону (Ме+) відповідає слабка основа, він зв’язує іони ОН–:
Ме+ + Н2О = МеОН + Н+.
Якщо аніону (А–) відповідає слабка кислота, він зв’язує іони Н+:
А– + Н2О = НА + ОН–.
В першому випадку з’являються іони Н+, що обумовлює підкислення розчину, а в другому випадку – іони ОН–, що обумовлює появу лужного середовища.
Приклад 28.
Скласти молекулярні та іонні рівняння гідролізу ціаніду калію. Який характер буде мати розчин?
Розв’язання.
Ціанід калію – сіль, що утворена слабкою кислотою (НСN) і сильною основою (КОН), гідроліз буде відбуватися по аніону.
Рівняння в молекулярному вигляді:
KCN + H2O = HCN + KOH.
Рівняння в іонному вигляді:
CN– + H2O = HCN + OH–.
В звязку з утворенням іонів OH– середовище буде лужним.
Добуток концентрацій іонів, на які дисоціює електроліт в насиченому розчині речовини за сталих температури й тиску, є сталою величиною. Цю величину називають добутком розчинності (ДР).
Добуток розчинності солі КnAm становитиме:
ДР(КnAm) = [K m+]n ´ [An-]m
За допомогою величин ДР можна сформулювати правила випадіння осаду: якщо добуток концентрацій іонів більший, ніж значення ДР солі, то осад випадає, якщо менший – не випадає.
Приклад 29.
Випаде, чи ні осад при змішуванні 200 мл 0,001 М розчину AgNO3 i 100 мл 2 10-5 М розчину HCl. (ДРAgCl = 1,7 10-10)
Розв'язання.
Випадіння осаду можливе при виконанні нерівності:
[Ag +] ´ [Cl-] > ДР(AgCl)
Після змішування концентрації іонів змінються завдяки розведенню:

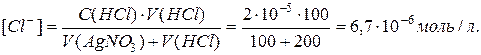
[Ag +] ´ [Cl-] = 4,5 10-9 > ДР(AgCl).
Тобто осад AgCl випаде.
Запитання для самоконтролю
1. Що таке розчини?
2. Що таке розчинність?
3. Що таке молярна концентрація, моляльність і мольна частка?
4. Як залежить тиск насиченої пари над розчином від його концентрації?
5. Як розрахувати температуру замерзання та температуру кипіння розчину?
6. Що таке осмотичний тиск?
7. Що таке електроліти та неелектроліти?
8. Що таке константа та ступінь дисоціації?
9. Які властивості води дозволяють використовувати її в пожежогасінні?
10. Що таке водневий показник середовища?
11. Чому дорівнює йонний добуток води?
12. В яких випадках можуть перебігати іонообмінні реакції?
13. Що таке гідроліз солей?
Читайте також:
| <== попередня сторінка | | | наступна сторінка ==> |
| Тиск насиченої пари над розчином дорівнює добутку його тиску над чистим розчинником на мольну частку розчинника. | | | Тема 9. Колоїдні системи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |