
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Однакові кількості електрики, що проходять крізь розчини різних електролітів, під час електролізу виділяють еквівалентні кількості речовин.
Другий закон Фарадея можна виразити рівнянням:
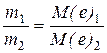 ,
,
де М(e) – молярні маси еквівалентів. Для електрохімічних процесів: М(e) = М/n, (n) – кількість електронів, необхідна для утворення 1 моль речовини на електродах.
При проходженні крізь електроліт 96500 кулонів електрики, виділяється один еквівалент будь-якої речовини. Цю кількість електрики називають “фарадеєм” і позначають літерою F.
На основі двох законів Фарадея можна записати рівняння, що дозволяють розрахувати масу або об’єм (для газів), які виділяються на електродах під час електролізу:
 ,
,
w - вихід за струмом (якщо нема побічних процесів w =1) .
Приклад 36.
Скільки і яких речовин виділиться на електродах при електролізі розчину сульфату цинку з інертними електродами, якщо протягом 1 години пропущено струм силою 5 А? Вихід за струмом металу та водню на катоді складають по 50 %, вихід за струмом газу на аноді 100% .
Розв'язання.
1). На катоді перебігають такі реакції:
(К) Zn2+ + 2e = Zn, 2H2O + 2e = H2 + 2OH–.
На аноді вилучиться кисень
(А) 2H2O – 4e = 4H+ + O2.
Маса речовин, що утворюється при електролізі, визначається законом Фарадея: m = m(e).I.t.w / F,
m(e)(Zn)=А(Zn)/2=65,4/2=32,7г/моль; m(e)(O)=А(О)/2=16/2=8 г/моль;
m(e)(H) = А(Н)/1=1 г/моль.
m(Zn)=32.7×5×3600×0,5/96500=3,05г; m(H)=1×5×3600×0,5/96500=0,093 г.;
m(O)=8×5×3600/96500= 1,49 г.
Запитання для самоконтролю
1. Що таке стандартний електродний потенціал?
2. Як розрахувати потенціал електрода?
3. Як називають електроди в хімічних джерелах струму?
4. Що таке електроліз?
5. Чим відрізняється електроліз розчинів від електролізу розплавів?
6. Яка кількість речовини окислюється або відновлюється на електродах при проходженні 96500 Кл електрики?
7. Які метали не можна добути шляхом катодного відновленíя водних розчинів?
Читайте також:
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- Аваріїз витоком сильнодіючих отруйних речовин.
- Адаптаційні зміни суглобово-зв'язкового апарату спортсменів різних спеціалізацій.
- Активний транспорт речовин. Дослід Уссінга
- Але різних за значенням
- Але різних за значенням.
- Алфавітний підхід до вимірювання кількості інформації.
- Аналіз витрат від різних видів діяльності
- Аналіз формування доходів підприємства від різних видів діяльності
- Анатерм-114 є клеєм -герметиком прискореного затвердіння, що дозволяє використовувати його у конвеєрних виробництвах при складанні різних вузлів і деталей.
- Анатомо-фізіологічні особливості організму людини різних вікових періодів, які впливають на фармакокінетику й фармакодинаміку ЛП.
- Арифметичні операції в різних системах числення
| <== попередня сторінка | | | наступна сторінка ==> |
| Електроліз | | | Тема 12 Корозія металів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |