
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Фізичні величини, що застосовуються в хімії
Оскільки абсолютні значення мас атомів і молекул є дуже малими величинами, то ними дуже незручно користуватися під час хімічних розрахунків. З огляду на це виникла необхідність ввести їх відносні значення.
Відносна атомна маса хімічного елемента(Аr)–це фізична величина, яка визначається відношенням маси атома (ma) елемента до однієї дванадцятої частки маси атома ізотопу Карбону С12:
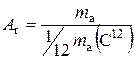 .
.
Відносна молекулярна маса(Мr)– це фізична величина, яка визначається відношенням маси молекули (mm) до однієї дванадцятої частки маси атома ізотопу Карбону С12:
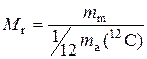 .
.
Відносну молекулярну масу можна обчислити як суму відносних атомних мас усіх елементів, що входять до складу молекули:
Mr = n1Ar¢ + n2Ar¢¢ + … + nAr.
Масова частка елемента, що входить до складу молекули, визначається за формулою
 .
.
Кількість речовини (n) –це фізична величина, яка визначається числом часток – структурних елементів речовини: молекул, атомів, іонів, іонних асоціатів.
Кількість речовини обчислюється співвідношенням
 ,
,
де N – число структурних елементів у певній порції речовини.
Якщо N=NA, то n=1. Ця одиниця в Міжнародній системі одиниць вимірювання має назву моль.
Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону С12 масою 0,012 кг.
Число атомів чи молекул, що містяться в речовині кількістю 1 моль, називають сталою Авогадро:


Молярна маса (М)– маса речовини кількістю 1 моль:
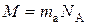 , г/моль.
, г/моль.
Mr і М однакові за величиною, однак молярна маса порівняно з відносною молекулярною масою має розмірність.
Якщо n = 1 моль, то маса речовини дорівнює молярній масі m = M , а якщо збільшити n, то в стільки ж разів збільшиться і маса речовини m, тобто
m = n×M, чи n =m/M.
Для газоподібних речовин важливою величиною є молярний об’єм.
Молярний об’єм –це об’єм газоподібної речовини кількістю 1 моль.
За нормальних умов (Р=101,3 кПа, t=0°C чи Т=273 К) молярний об’єм будь-якої газоподібної речовини дорівнює VM=22,4 л/моль.
Таким чином, кількість речовини можна визначити за формулою
n = V/VM.

 1.1.4. Основні закони хімії
1.1.4. Основні закони хімії
Основні закони хімії були відкриті наприкінці XVIII – на початку XIX ст. і послужили базою для перетворення хімії на науку, що застосовує математичні методи.
|
|
|
маса речовин, що вступають у хімічну реакцію, дорівнює загальній масі речовин, що утворюються в результаті реакції.
Якщо хімічну реакцію зобразити в загальному вигляді
А + B = C + D,
то закон можна записати так:
m(A + B) = m(C + D).
Наприклад: 2H2 + O2 = 2H2O
2×2 32 2×18 .

36 36
2.Закон cталості складу сформулював у 1808 р. Пруст:
Кожна хімічна сполука незалежно від способу її добування складається з одних і тих же елементів, причому відношення їх мас постійні, а відношення кількості атомів виражаються цілими числами.
 Пізніше у зв'язку з розробкою і впровадженням методів, що дозволяли точніше визначати елементний склад сполук, була виявлена обмеженість дії законів Дальтона й Пруста. Доведено, що вони справедливі тільки для рідких і газоподібних сполук із молекулярною структурою (наприклад, SO2, SO3, NH3, CH4). Такі сполуки на честь Дальтона названі дальтонідами.
Пізніше у зв'язку з розробкою і впровадженням методів, що дозволяли точніше визначати елементний склад сполук, була виявлена обмеженість дії законів Дальтона й Пруста. Доведено, що вони справедливі тільки для рідких і газоподібних сполук із молекулярною структурою (наприклад, SO2, SO3, NH3, CH4). Такі сполуки на честь Дальтона названі дальтонідами.
|
|
|
 може бути зображений формулою Fe1-xO, де х<1, тобто залежно від умов можна отримати оксиди складу Fe0,93O чи Fe0,89O.
може бути зображений формулою Fe1-xO, де х<1, тобто залежно від умов можна отримати оксиди складу Fe0,93O чи Fe0,89O.
3.Закон об'ємних відношеньвідкрив у 1808 р. Гей-Люссак:
Читайте також:
- I. Фізичні основи механіки
- А/. Фізичні особи як суб’єкти цивільного права.
- Аміни. Фізичні та хімічні властивості аліфатичних амінів.
- БІОФІЗИЧНІ ОСНОВИ ЗОРОВОЇ РЕЦЕПЦІЇ
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Будова оптоволокна та основні фізичні явища в оптоволокні.
- Будова, склад та фізичні властивості Землі
- В усній формі договір позики може бути укладений якщо його сторонами є фізичні особи і якщо сума позики не перевищує 10 неоподатковуваних мінімумів доходів громадян.
- Величини, що вивчаються в курсі математики І – ІV класів
- Види покарань, які застосовуються до неповнолітнього, і особливості їх призначення
- Види стягнень, що застосовуються до курсантів і старшин
- Вимірника, які застосовуються в обліку
| <== попередня сторінка | | | наступна сторінка ==> |
| Ключові положення атомно-молекулярного вчення | | | За умов сталих тиску й температури об'єми реагуючих між собою газів, а також об'єми газоподібних продуктів реакції відносяться як невеликі ці лі числа. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |