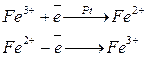РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Виникнення електродного потенціалу
Якщо пластинку з активного металу (наприклад, Cu, Zn, Ag) занурити в розчин, що містить іони цього металу, то на межі розділу фаз метал–розчин можливо протікання двох процесів: мікророзчинення металу і мікровиділення металу на поверхні електроду. У випадку, коли електрохімічний потенціал у металічній фазі більший, ніж у розчині, спочатку відбувається перехід металу з поверхні електрода у розчин, тобто розчинення металу. При цьому на поверхні електроду виникає надлишок від’ємного заряду (електронів), а у розчині поблизу електроду – надлишок позитивно заряджених іонів металу – виникає подвійний електричний шар. У випадку, коли електрохімічний потенціал у розчині більший, має місце процес відновлення металу та поверхня металічної фази містить надлишок позитивного заряду. В результаті на границі розділу фаз метал–розчин встановлюється динамічна рівновага: швидкості процесів розчинення та відновлення стають однаковими. Стрибок потенціалу у цьому шарі називається електродним потенціалом.
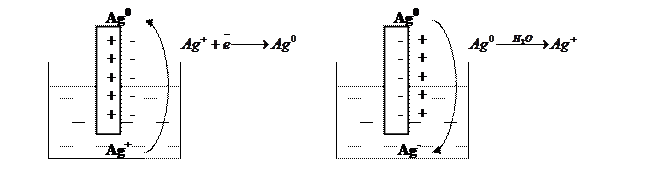

Якщо пластинку з благородного металу (Pt, Au, Pd, Ru, Os) занурити в розчин, то мікророзчинення відбуватися не буде, так як іони у вузлах кристалічної решітки таких металів зв’язані дуже міцно. Виникнення потенціалу в цьому випадку пояснюється обміном електронів між електродом та іонами в розчині:
|


Якщо концентрація іонів Fe3+ у розчині збільшується, на поверхні електроду у металічній фазі виникає надлишок позитивних зарядів, які притягують протилежно заряджені іони з розчину. Виникає подвійний електричний шар і після встановлення рівноваги – рівноважний електродний потенціал. Чим більша сила окисника, тим більше він віднімає електронів до моменту рівноваги і тим більшим буде потенціал.
Якщо збільшується концентрація Fe2+ – поверхня електроду заряджується негативно, а у розчині поблизу електроду виникає надлишок позитивних іонів.
Аналіз рівняння Нернста показує, що величина потенціалу залежить від:
1) природи речовини (Ео);
2) температури;
3) співвідношення активностей (концентрацій) окисненої і відновленої форм;
4) рН розчину;
5) іонної сили розчину (µ): 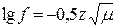 . При збільшенні іонної сили розчину зменшуються коефіцієнт активності і відповідно активність іонів.
. При збільшенні іонної сили розчину зменшуються коефіцієнт активності і відповідно активність іонів.
| <== попередня сторінка | | | наступна сторінка ==> |
| Сутність потенціометричного методу | | | Електроди в потенціометричному методі |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |