
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електроди в потенціометричному методі
Безпосередньо потенціал електроду виміряти не можна. Для його визначення збирають гальванічний елемент, що складається з індикаторного електроду і електроду порівняння.
Індикаторний електрод – електрод, потенціал якого залежить від концентрації визначуваного іона.
Індикаторний електрод повинен бути:
– оберненим по відношенню до визначуваного іона, тобто його потенціал повинен змінюватися зі зміною концентрації визначуваного іона згідно з рівнянням Нернста;
– хімічно стійким (інертним), тобто не реагувати з іонами в розчині;
– потенціал повинен встановлюватися швидко і бути відтворюваним.
Види індикаторних електродів:
1. Металічні електроди першого роду – металева пластина або дріт з активного металу (Cu, Zn, Ag) занурена в розчин добре розчинної солі цього металу – використовуються для визначення концентрації іонів того самого металу, що і метал електроду. В такій системі відновленою формою є метал і в рівнянні Нернста авід=1;
Наприклад, срібний дріт занурений у розчин арґентум нітрату. На поверхні електроду відбувається оборотна реакція Ag+ + e ↔ Ag і рівняння Нернста має вигляд: 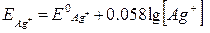 .
.
2. Металічні редокс-електроди – електроди з благородного інертного металу (Pt, Au, Pd, Ru, Os), потенціал якого залежить від співвідношення активностей окисненої і відновленої форм  .
.
Наприклад, платиновий дріт занурений у розчин, що містить солі Sn2+ та Sn4+.
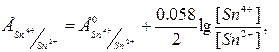
3. Електроди другого роду – активний метал, вкритий малорозчинною сполукою цього метала і занурений в розчин добре розчинної сполуки з тим самим аніоном (каломельний, хлорсрібний). Такі електроди є оборотними до аніону, тобто їх потенціал залежить від концентрації аніону. Наприклад, хлорсрібний електрод – це металічна срібна дротина, вкрита малорозчинною сіллю AgCl та занурена у розчин, що містить Cl–.
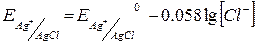 .
.
4. Мембранні (іоноселективні електроди). Це найбільша та у теперішній час найважливіша група електродів. Найважливішою частиною такого електроду є тонка мембрана, що має здатність обмінюватися з розчином іонами, причому лише катіонами або аніонами, а в багатьох випадках лише якимись конкретними іонами. Потенціал таких електродів обумовлений не електрохімічною реакцією з переносом електрона, а різницею потенціалів, яка виникає на межі розділу фаз, і рівновагою обміну іонів між мембраною і розчином.
 Мембранні електроди конструюються таким чином, що мембрана відокремлює внутрішню частину електрода, заповнену стандартним розчином, від розчину, що аналізується. Матеріал мембрани містить електродноактивну речовину, яка і обмінюється іонами з розчином. Більш детально роботу мембранного електроду розглянуто на прикладі скляного електроду у розділі 4.2.1.
Мембранні електроди конструюються таким чином, що мембрана відокремлює внутрішню частину електрода, заповнену стандартним розчином, від розчину, що аналізується. Матеріал мембрани містить електродноактивну речовину, яка і обмінюється іонами з розчином. Більш детально роботу мембранного електроду розглянуто на прикладі скляного електроду у розділі 4.2.1.
В залежності від типу мембрани мембранні електроди бувають:
– тверді – мембрана виготовлена з малорозчинної кристалічної речовини з іонним характером провідності. Перенос заряду відбувається за рахунок дефектів кристалічної решітки (наприклад, монокристал LaF3 для визначення фтори-іонів; скляний електрод для визначення рН);
– рідкі – розчин органічної іонної сполуки в органічному розчиннику, нанесений на полімерний носій (наприклад, рідка мембрана на основі кальцієвої солі ефіру фосфорної кислоти для визначення іонів кальцію);
– ферментні – електроди вкриті шаром ферменту, що викликає реакцію органічної чи неорганічної речовини з утворенням продукту, що обумовлює відгук електрода (наприклад, при визначанні сечовини фермент уреаза викликає реакцію утворення амоніаку із сечовини, при цьому використовують NH4+-селективний електрод для визначення кількості продукту, що утворився).
Електроди порівняння – електроди, потенціал яких лишається постійним, тобто не залежить від концентрації іонів у розчині, на відміну від індикаторних електродів. До них відноситься стандартний водневий електрод (СВЕ) та електроди 2-го роду (наприклад, хлорсрібний, каломельний), потенціал яких залежить від активності аніону. Але на відміну від індикаторного електроду другого роду, електрод порівняння занурений у розчин з постійною відомою концентрацією аніону, наприклад, срібна дротина вкрита арґентум хлоридом занурена в насичений розчин калій хлориду (хлорсрібний електрод порівняння). Як показує аналіз рівняння Нернста, при постійній концентрації аніонів потенціал електроду лишається практично незмінним в невеликому діапазоні температур.
При складанні гальванічного елементу для визначення концентрації речовини потенціометричним методом необхідно звернути увагу на можливість взаємодії іонів розчину, в який занурений електрод порівняння, з визначуваним іоном. Наприклад, при визначені концентрації іонів срібла використовують срібну дротину як індикаторний електрод, та хлорсрібний чи каломельний електрод порівняння. Якщо занурити один з цих електродів порівняння у досліджуваний розчин, визначувані іони срібла будуть утворювати осад з хлорид іонами. У цьому випадку електрод порівняння з’єднують з досліджуваним розчином за допомогою сольового містка, заповненого натрій нітратом. Сольовий місток слугує також для нівелювання дифузійного потенціалу.
| <== попередня сторінка | | | наступна сторінка ==> |
| Виникнення електродного потенціалу | | | Дифузійний потенціал |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |