
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Визначення рН
Як індикаторні в цьому методі використовують електроди, потенціал яких залежить від рН розчину.
Водневий електрод – платинова пластина, вкрита шаром пористої платини (“черні”), через яку пропускають газоподібний Н2 з р=1 атм., занурена в розчин з невідомою концентрацією іонів водню:
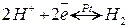 ,
,
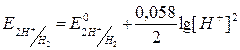 ,
,
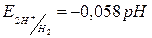 .
.
Він дозволяє працювати в інтервалі 1÷13 рН. Водневий електрод через складність конструкції використовують рідко. Крім того він має значні недоліки: після кожного визначення необхідно насичувати його чистим газоподібним Н2 протягом години; неможливо вимірювати рН розчинів, що містять сильні окисники і відновники; потенціал встановлюється повільно.
Хінгідронний електрод представляє собою платинову пластинку в розчині хінгідрону – малорозчинної молекулярної сполуки, яка являє собою суміш хінона і гідрохінона:
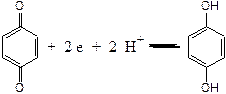
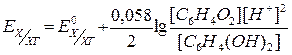 ,
,
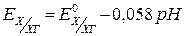 ,
, 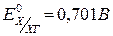 .
.
Його недоліками є: неможливість працювати в сильно лужних середовищах через те, що при рН>9 гідрохінон окислюється киснем повітря; не можна проводити вимірювання рН в розчинах, що містять окисники або відновники, які реагують з хіноном або гідрохіноном порушуючи тим самим рівновагу їх концентрацій.
Металооксидні електроди являють собою метал, вкритий плівкою оксиду цього металу (стибій-оксидний, свинцевий). Металічний електрод в присутності свого малорозчинного оксиду володіє водневою функцією. Такі електроди застосовують при роботі в інтервалі 3÷10 рН, а також при визначенні рН грунту. Недоліком таких електродів є неможливість застосування в розчинах, що містять окисники і відновники.
Скляний електрод (рис. 4.1). Це скляна мембрана (до δ=0,01 мм), припаяна до трубки зі звичайного скла. Мембранне скло має певний склад: SiO2 – 72%; Na2O – 6%; Li2O – 22%. Всередині електрода знаходиться НСl визначеної концентрації і допоміжний хлорсрібний електрод. Іони Н+, що знаходяться всередині електрода обмінюються з іонами Na+ (Li+, тощо) мембрани. Коли такий електрод занурити в досліджуваний розчин, в якому потрібно визначити концентрацію Н+, за рахунок різниці концентрацій Н+ в досліджуваному розчині і мембрані встановлюється динамічна рівновага. Величина різниці потенціалів (граничний потенціал) пропорційна концентрації Н+ в досліджуваному розчині. Тобто електродна реакція зводиться до обміну Н+ досліджуваного розчину і скляної мембрани.



Н+х || скляна мембрана || H+ст.
зовнішній шар внутрішній шар
(досліджуваний розчин) 0,1 М HCl
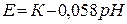
|
|
|

Рис. 4.1 Схема скляного електрода
Перевагами скляного електроду є: широкий діапазон вимірювання; можливість вимірювати рН розчину в присутності окисників і відновників; потенціал встановлюється швидко і є відтворюваним.
Недоліком є те, що лінійна залежність потенціалу від концентрації Н+ порушується в сильно кислих і сильно лужних середовищах.
| <== попередня сторінка | | | наступна сторінка ==> |
| Дифузійний потенціал | | | Способи визначення концентрації в прямій потенціометрії |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |