
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Потенціометричні аналізатори.
Електроди.
Потенціометричні аналізатори.
Потенціометричні аналізатори рідин широко застосовуються практично у всіх галузях харчової промисловості. З їхньою допомогою може бути обмірювана концентрація в розчинах іонів водню у всьому діапазоні зміни від самих кислих до самих лужних середовищ, іонів різних речовин (Na, Са, Mg, Li і ін.), а також визначені окислювально-відновні потенціали практично будь-яких середовищ.
В основі потенциометрического методу аналізу лежить використання рівняння Нернста, що описує залежність потенціалу металевого електрода Е, щопоміщається в розчин, від природи й активності іонів у розчині:
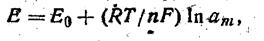 (XI. 14)
(XI. 14)
де Ео-Складова міжфазна різниця потенціалів, що визначається властивостями електрода й не залежить від концентрації іонів у розчині, В; R — універсальна газова постійна, Дж/( моль-до); Т — температура, ДО; п-п — валентність; F — число (постійна) Фарадея, Кл/моль; ат — активність іонів у розчині.
Виражене через стандартний (нормальний) потенціал, що виникає на електроді, коли активність ат=1, рівняння Нернста приймає вид
 (XI.15)
(XI.15)
Виникнення потенціалу - стрибок потенціалу пояснюється динамічною рівновагою, при якому перехід електронів від відновлювача до електрода й від електрода до окислювача відбувається з однаковою швидкістю.
Для потенціометричних вимірів використовуються електроди двох видів: першого й другого роду. Електроди першого роду - металеві, чутливі-до активності своїх катіонів у розчині (ртутні, срібні, мідні, свинцеві, водневі й ін.). Однак більшість металів швидко окисляється, і їх електродна функція порушується, тому вони у вимірах, як правило, не застосовуються. Електроди другого роду складаються з металевого електрода й малорозчинна солі того ж металу, наприклад хлорсеребряні й каломельні. Потенціал такого електрода залежить від активності аніона малорозчинній солі.
Особливу групу представляють електроди з інертних металів, застосовувані для відновних вимірюваноокисних відбудовних потенціалів, що характеризують відношення окисленої й відновленої форм в аналізованому розчині.
Метод потенціометричного виміру концентрації іонів у розчинах заснований на вимірі різниці електричних потенціалів двох спеціальних електродів, що поміщаються в аналізоване середовище, причому один з електродів є допоміжним, в процесі виміру свій потенціал змінювати не повинен. У якості допоміжних при потенціометричних вимірах використовуються електроди другого роду.
Потенціометричний метод широко застосовується для виміру активності іонів водню, що характеризують кислі або лужні властивості аналізованих середовищ. Поява водневих іонів у розчинах викликано дисоціацією частини молекул води так іони водню й гідроксильні іони, тобто:
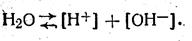
Оскільки вода є з'єднанням нейтральним, концентрація тих і інших іонів однакова, а отже, справедливо наступна рівність:
[Н+] = [ВІН-]
Добуток концентрації іонів водню на концентрацію іонів гідроксилу як для чистої води, так і для водяних розчинів відповідно до закону діючих мас є величиною постійної при даній температурі й визначається константою дисоціації води:
Кв = ДО[Н2ПРО] == [Н+](ВІН-]
Чисельне значення Кв при 22°С характеризується числом ДО)-14. Тому що при дисоціації води утвориться однакове число водневих і гідроксильних іонів (Н+=ОН~), те концентрація тих і інших дорівнює 10~7.
Кислоти й луги у водяних розчинах також дисоціюють на кислоти на іони водню, а луги - на катіони металу й іони гідроксилу:
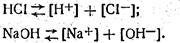
З підвищенням концентрації кислоти в розчині підвищується концентрація іонів водню, а з підвищенням концентрації лугу в розчині - концентрація іонів гідроксилу, що викликає зменшення концентрації іонів водню. Отже, концентрацією водневих іонів можна характеризувати будь-які розчини. На практиці концентрацію водневих іонів прийнято чисельно виражати негативним десятковим логарифмом концентрації іонів водню [Н+]. Ця величина називається водневим показником рН і визначається вираженням:
p=-lg[H+] (XI.16)
Отже, нейтральна реакція розчину відповідає значенню рН, рівному 7, кисла реакція — рН<7, а лужна — рН>7 (від 7 до 14). Дуже кислі й дуже лужні розчини можуть характеризуватися значенням рН менше нуля (— 1-1-;—2) і більше 14 (15—16).
Розглянуті залежності строго справедливі для слабких електролітів при не дуже більших концентраціях. При вимірі рН концентрованих розчинів або сильних електролітів необхідно враховувати електростатичні сили взаємодії між іонами, для чого варто вводити поправочний множник - коефіцієнт активності як правило, має значення менше одиниці. Уточнена формула водневого показника рн має такий вигляд РН => - Ig«н або РН = - lg(/н [Н+]), " (XI. 17)
де ая — активність іонів водню в розчині.
Слід зазначити, .що значення рН, вимірювані електричними методами, характеризують не дійсні концентрації кислоти або лугу в розчині, а активні маси іонів, або їхня активність.
Читайте також:
- Потенціометричні визначення концентрації водневих розчинів.
- Прямі потенціометричні вимірювання.
- Фотоколориметричні газоаналізатори.
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Електроди. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |