
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Рівноваги в окисно – відновних реакціях
Окисно – відновні реакції мають велике значення в практиці аналітичної хімії. Зокрема, вони використовуються в якісному аналізі для виявлення та відокремлення окремих катіонів і аніонів, розчинення різних речовин чи для маскування іонів.
Кількісне трактування закономірностей окисно–відновних реакцій у розчинах електролітів ґрунтується на обчисленні стандартної зміни енергії Гіббса реакції. Значення енергії Гіббса є критерієм можливості і глибини проходження окисно-відновної реакції в заданому напрямі. За величиною енергії Гіббса можна зробити висновок про напрям проходження окисно-відновних реакцій.
Якщо DG< 0, то реакція самочинно проходить тільки в прямому напрямі; якщо DG > 0 – у зворотному напрямі; при DG=0 – система перебуває в стані рівновагі.
Зв'язок DG з константою рівноваги виражається рівнянням:
DG0= - RT lg Kp.
Окисно-відновні властивості речовини визначаються за їх хімічною активністю. Остання виражається через окисно-відновний (окс-ред-) потенціал, який є стандартний Е0Ok/Red і реальний ЕOk/Red. Реальний окисно-відновний потенціал виражається рівнянням Нернста:
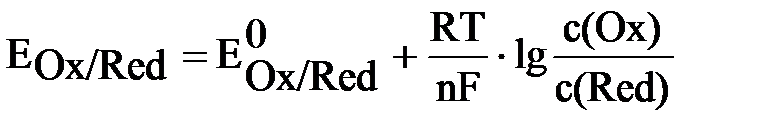 .
.
Значення стандартних окисно-відновних потенціалів дозволяють зробити висновок про можливість проходження реакції за стандартних і реальних умов: якщо різниця стандартних або реальних окисно-відновних потенціалів(електрорушійна сила – е.р.с.) вихідних речовин реакції позитивна, то можливе проходження реакції в напрямі утворення продуктів реакції.
е.р.с. =ЕОх0 – ЕRed0.
Константа рівноваги окисно-відновної реакції визначається за формулою:
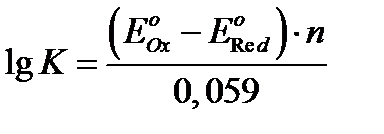 .
.
Оксред-пара з більшим стандартним окисно-відновним потенціалом є окисником по відношенню до оксред-пари з меншим стандартним окисно-відновним потенціалом .Наприклад, пара MnO4-/Mn2+ по відношенню до пари Br2/2Br- буде окисником, оскільки Ео(MnO4-/Mn2+) = +1,51 В, а Ео( Br2/2Br-) = + 1,087 В.
| <== попередня сторінка | | | наступна сторінка ==> |
| ЗАДАЧІ ДЛЯ САМОСТІЙНОЇ РОБОТИ | | | Приклади розв’язання задач |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |