
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
А. Спільні хімічні властивості піролу, фурану та тіофену
1. Взаємодія з мінеральними кислотами.У присутності сильних мінеральних кислот пірол і фуран осмолюються, утворюючи полімерні продукти темного кольору. Ця властивість дістала назву ацидофобність,
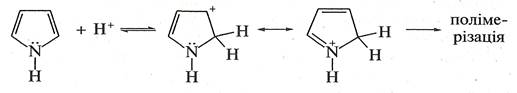
що означає «кислотобоязнь», від лат. acidum — кислота і грец. фобос — страх. Ацидофобність зумовлена приєднанням протона, переважно до а-атома циклу, що призводить до порушення ароматичності кільця. Потім відбувається полімеризація утвореної дієнової структури.
Уведення в пірольне ядро електроноакцепторних замісників (—NO2, —СООН, —СН=O) веде до зменшення ацидофобності цих сполук. Тіофен, на відміну від фурану та піролу, не виявляє ацидофобності, оскільки має стійку ароматичну структуру, яка не руйнується при дії сильних мінеральних кислот.
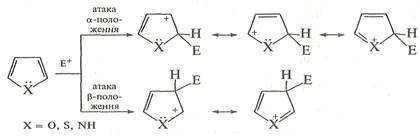
2. Реакції електрофільного заміщення.Будучи π-надлишковими ароматичними системами, пірол, фуран і тіофен легко вступають у характерні для ароматичних сполук реакції електрофільного заміщення. Ці реакції відбуваються значно легше, ніж у бензену. За активністю в реакціях з електрофільними реагентами означені ге-тероцикли розташовуються в ряд: пірол > фуран > тіофен. У першу чергу заміщується атом Гідрогену при атомі Карбону в α-положенні; якщо це положення зайняте, заміщення відбувається в β-положенні. Такий напрямок заміщення зумовлений тим, що за участю атомів Карбону в α-положенні утворюється стійкіший δ-комплекс, завдяки більшій можливості для делокалізації позитивного заряду.
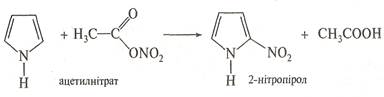
Нітрування. Зважаючи на ацидофобність фурану та піролу, нітрування їх проводять не самою нітратною кислотою, а продуктом взаємодії нітратної кислоти з оцтовим ангідридом — ацетилнітратом CH3COONО2. Тіофен неацидофобний, тому його можна пронітрувати нітратною кислотою за м'яких умов, однак частіше в реакції нітрування тіофену також застосовують ацетилнітрат. Унаслідок нітрування утворюються α-нітросполуки.
Те ж саме стосується реакції сульфування.
Галогенування. Галогенування фурану проходить досить складно. Поряд із заміщенням атомів Гідрогену на галоген залежно від умов проведення реакції утворюються також продукти 2,5-приєднання.
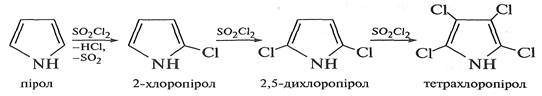
Пірол з галогенами реагує дуже легко, утворюючи тетрагалогенопіроли. Для здобування моногалогенозаміщених похідних піролу потрібні спеціальні умови. Так, при дії на пірол сульфурилхлориду S02C12 відбувається поступове заміщення атомів Гідрогену на галоген.
Тетрайодпірол (йодол) виявляє властивості антисептика.
Галогенування тіофену проводять безпосередньою дією галогену (хлору або брому). Реакція проходить на холоді з утворенням моно-, ди-, три- і тетразаміщених похідних тіофену.
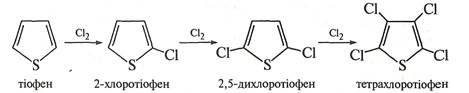
Реакція з йодом відбувається повільно в присутності каталізатора HgO.
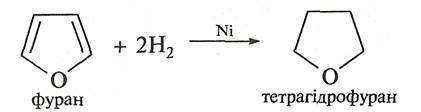
3. Реакції відновлення.Фуран приєднує водень при високій температурі (150 °С) та тиску (10—15 МПа) у присутності каталізатора (нікелю Ренея, паладію) з утворенням насиченого гетероциклу тетрагідрофурану (оксолану).
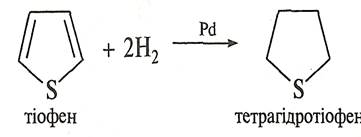
Приєднання водню до тіофену в присутності паладієвого каталізатора відбувається значно легше, ніж до фурану (при кімнатній температурі та тиску 0,2—0,4 МПа). У процесі відновлення утворюється тетрагідротіофен.
Пірол, на відміну від фурану та тіофену, гідрується воднем у момент виділення, наприклад, дією цинку в оцтовій кислоті. При цьому відбувається часткове відновлення кільця з утворенням ненасиченого гетероциклу — 2,5-дигідропіролу (піроліну). Повне відновлення пірольного циклу відбувається при гідруванні над платиновим або паладієвим каталізатором. Як результат — утворюється тетрагідропірол (піролідин).
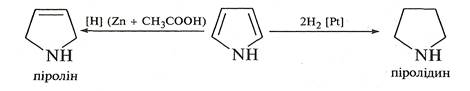
Піролін і піролідин є циклічними амінами, що істотно відрізняються за хімічними властивостями від піролу.
У молекулі піроліну неподілена пара електронів атома Нітрогену не спряжена з π-електронами подвійного зв'язку, тому він виявляє властивості амінів і ненасичених сполук. А піролідин належить до насичених сполук — це типовий представник вторинних циклічних амінів. Піролідиновий цикл входить до складу багатьох природних сполук, таких, як алкалоїди, нікотин, кокаїн, атропін та ін.
4. Реакції окиснення.Фуран і пірол дуже чутливі до дії окисників і окиснюються навіть киснем повітря. При окисненні відбувається розрив гетероциклічного ядра і утворюються полімерні сполуки.
Проте пропускання суміші фурану з повітрям над каталізатором V2О5 при температурі 320 °С приводить до утворення ангідриду малеїнової кислоти.
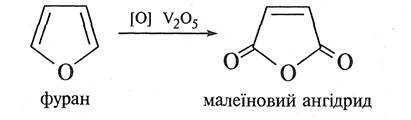
При окисненні піролу хромовою кислотою утворюється імід малеїнової кислоти.
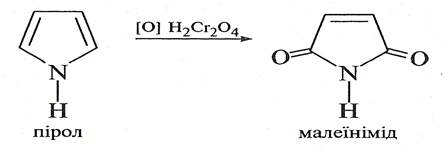
Тіофен дуже важко піддається окисненню.
5. Взаємні перетворення фурану, піролу та тіофену.Реакція проходить при температурі 450 °С у присутності каталізатора А12О3
| <== попередня сторінка | | | наступна сторінка ==> |
| ФІЗИЧНІ ВЛАСТИВОСТІ | | | Б. Специфічні хімічні властивості піролу |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |