
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Ацилювання.
Введення ацильної групи в молекулу органічної сполуки за допомогою наступних основних способів.
– заміщення атому водню на ацильну групу при дії карбонових кислот або їх похідних

Y= OH, Cl, OR, N і т.д.
Аналогічно заміщають на ацильну групу атом водню при атомах азоту, кисню, сірки.
- ацилювання ароматичних сполук ацилхлоридами в присутності хлориду алюмінію отримало назву реакції Фріделя-Крафтса
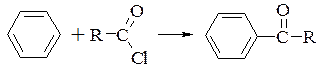
- ацилювання амінів і спиртів (N- і С-ацилювання) дією ацилхлоридів в водному розчині лугу називають реакцією Шоттена-Баумана
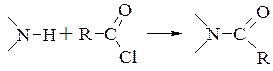
- О-ацилювання спиртів і фенолів в надлишку піридину носить назву реакції Айнхорна
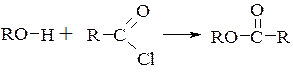
12.1. С-ацилювання.
Ацилювання поряд з алкілуванням – найбільш поширена реакція ароматичного заміщення під дією С-електрофілів. Введення ацильної групи приводить до утворення арилкетонів, а при внутрішньо молекулярному ацилюванні – до циклічних кетонів і хінонів. Введення залишку мурашиної кислоти приводить(формілювання) до утворення альдегідів.
При отриманні арилкетонів реагентами служать карбонові кислоти, їх галогеніди, ангідриди, ефіри, аміди, нітрили. Активність реагенту тим вища, чим більший позитивний заряд на карбонільному атомі вуглецю в ацильному залишку (RCOCl>(RCO)2O>RCOOH>RCOOAlk). При дії змішаного ангідриду двох карбонових кислот в ароматичне кільце вступає переважно більш електроноакцепторна ацильна група, а при рівній електроноакцепторності більший ацильний залишок.
Для збільшення позитивного заряду на атомі вуглецю, який атакує, використовують ті ж каталізатори, що і для реакції алкілування. Активність ацилгалогенідів в залежності від природи галогену зменшується в ряду I>Br>Cl>F, що протилежно ряду при алкілуванні алкілгалогенідами, де каталізатор координується по атому галогену. На 1 моль реагенту звичайно використовують не менше 1 моля кислоти Льюїса.
В якості середовища можна використовувати надлишок субстрату і різні розчинники, які інертні в умовах реакції, – дихлоретан, хлороформ, нітробензен, сірковуглець.
Реакція ацилювання, як і реакція алкілування зворотна.
О-ацильні похідні фенолів під дією каталізаторів Фріделя-Крафтса перегруповуються в орто- і пара-ацилфеноли (перегрупування Фріса).
12.2. N-ацилювання.
Часто ацильний залишок вводиться в аміногрупу ароматичних сполук тимчасово, для надання їм певної реакційної здатності (відповідної орієнтації при електрофільному заміщенні), для захисту аміногрупи (в тому числі і від окислення), а потім видалення. В такому випадку використовують найбільш дешеві ацилюючі агенти – мурашину або оцтову кислоту.
Наприклад, отримання 2-нітро-п-фенілендіаміну.
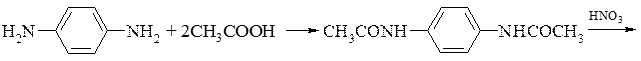

В деяких випадках ацильний залишок зберігається в кінцевому продукті. В такому випадку поряд з мурашиною і оцтовою кислотою використовують фосген, бензоілхлорид, бензенсульфонілхлорид і т.д.
Реакція ацилювання кислотами зворотна, тому для її успішного виконання використовують надлишок (до 4 молів) кислоти або видаляють воду, що утворилася під час реакції.
Так, для введення ацетильної групи використовують оцтову кислоту, краще льодяну, яку використовують з надлишком 10-15%. Ацетилювання проводять при кипінні реакційної маси. Вода, що утворилася в реакції відганяється разом з надлишком кислоти, а температура в масі підвищується до 150-170°С і ацетилювання закінчується.
12.3. О-ацилювання ароматичних гідроксисполук
Для ацилювання гідроксисполук використовують хлорангідриди і ангідриди карбонових кислот в водно-лужному розчині.
При використанні хлорангідридів карбонових кислот або сульфокислот добавляють лужні агенти, наприклад луг, для зв’язування хлористого водню. Крім того під дією лугу гідроксисполука перетворюється в більш реакційноздатний аніон, що збільшує швидкість реакції.
В сильно лужному середовищі можливо селективне О-ацилювання аміногідроксисполук. В цих умовах гідроксигрупа іонізована, утворений аніон має значно більшу нуклеофільність, ніж аміногрупа, і ацилюється в першу чергу. Так в сильно лужному середовищі при низьких температурах при взаємодії Аш-кислоти з бензенсульфонілхлоридом отримують 4-аміно-5-фенілсульфонілоксинафтален-2,7-дисульфокислота.

В деяких випадках О-ацилювання використовують для тимчасового захисту гідроксигрупи (к-ти Шиффера). О-ефір амінують через хлорангідрид по сульфогрупі, а потім омиляють при нагріванні з 5-10% водним розчином лугу.
| <== попередня сторінка | | | наступна сторінка ==> |
| Реакції алкілування | | | Окислення. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |