
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакції алкілування
Введення алкільної групи в органічну сполуку проводять за допомогою наступних реакцій:
– заміщення водню або металу на алкільну групу.

Y= H, M; Z= X, OH, R2N і інші.
В якості алкілюючого реагенту використовують алкілгалогеніди, спирти, алкілсульфати, аміни. Реакція є загальною для вуглеводнів і сполук з функціональними групами – в аліфатичному, ароматичному, аліциклічному і гетероциклічному ряді.
- Алкілування ароматичних сполук алкілгалогенідами в присутності хлориду алюмінію носить назву реакція Фріделя-Крафтса

- О-алкілування фенолів в розчині ацетону в присутності поташу отримала назву реакції Кляйзена.
Реакції алкілування мають практичне значення для синтезу алкільованих в ядро ароматичних сполук, ізопарафінів, меркаптанів, амінів, продуктів переробки α-окислів і ацетилену.
Найбільш раціональна класифікація процесів алкілування ґрунтується по типу нового утвореного зв’язку:
- алкілування по атому вуглецю (С-алкілування)
- алкілування по атомам кисню і сірки (О- і S-алкілування) представляє собою реакцію, в результаті якої алкільна група зв’язується з атомом кисню або сірки, тобто утворюються прості ефіри і меркаптани
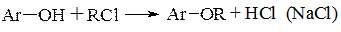

- алкілування по атому азоту (N-алкілування) полягає в заміщенні атомів водню в аміаку на алкільні групи. Це важливий метод синтезу аліфатичних амінів

- алкілування по атомах інших елементів (Si, Pb, Al-алкілування) важливий шлях отримання елементоорганічних і металоорганічних сполук


- при введенні фенольної або взагалі арильної групи утворюється безпосередньо зв’язок з атомом ароматичного ядра (арилювання)

- β-оксіалкілування (оксиетилювання) введення оксизаміщених алкільних груп


Всі алкілюючі агенти по типу зв’язку, який розривається при алкілуванні, можна розділити на групи:
- ненасичені сполуки (олефіни і ацетилен), в яких проходить розрив π-електронного зв’язку між атомами вуглецю;
- галогенпохідні з достатньо рухливим атомом галогену, який здатний заміщуватися під впливом різних реагентів;
- спирти, прості і складні ефіри, в тому числі окисли олефінів, в яких при алкілуванні розривається вуглець-кисневий зв’язок;
11.1 Алкілування ароматичних сполук в ядро
Велике значення має реакція алкілування по Фріделю-Крафтсу. Активність алкілгалогенідів залежить від природи галогену і зменшується в ряду: RF>RCl>RBr>RI. Алкілди- і алкілтригалогеніди з однаковими атомами галогенів обмінюють їх з утворенням ди- і триарилалканів; наприклад при взаємодії бензену з дихлорметаном утворюється дифенілметан.
Для реагентів всіх типів в залежності від характеру алкіла активність зменшується в ряді: бензил>трет-алкіл>втор-алкіл>перв-алкіл, відповідно зі збільшенням стабільності карбокатіонів.
Каталітична активність кислот Льюїса при алкілуванні зменшується в ряді:
AlBr3>AlCl3>FeCl3>BF3>ZnCl2>SnCl4>TiCl4
Кількість каталізатора коливається від еквімолярного до кількох мольних процентів.
Реакція алкілування є зворотною реакцією, що відображається на ізомерному складі продуктів. В присутності каталізатора AlCl3+HCl о- і п-диалкілбензени перегруповуються в мета-ізомери. Взаємодія 1,4-дитретбутилбензену з трет-бутилхлоридом в присутності хлористого алюмінію при мінус 7°С служить препаративним методом отримання 1,3,5-три-трет-бутилбензену (вихід 75%). Легкість переносу трет-бутильної групи дозволяє використовувати її в якості захисної групи для блокування певного положення і двох сусідніх положень з наступним відщепленням при нагріванні в бензені з хлористим алюмінієм.
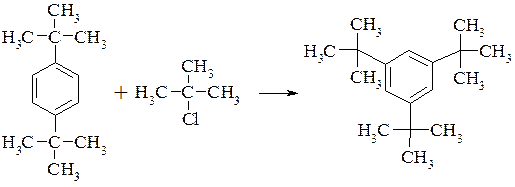
Алкільні катіони, які генеруються при взаємодії алкілюючого реагенту і каталізатора або при відщепленні від аренієвого іону, зазнають типового для карбокатіонів скелетного перегрупування з утворенням термодинамічно більш стабільного катіона. Нагадаємо, що стабільність катіонів зменшується в ряді: третинний>вторинний>первинний. Так при алкілуванні н-пропілбромідом утворюються переважно ізопропілзаміщені. Ізомеризація може проходити як до, так і після реакції алкілування.
Алкілуванням бензену в промисловості отримують етилбензен для виробництва стиролу, ізопропілбензен (кумол) для фенолу, вищі алкілбензени для ПАР – алкілбензенсульфонатів. Біля 50% бензену, що виробляється, переробляється в етилбензен, 20% в кумол.
Кумол отримують алкілуванням бензену пропеном. В рідкій фазі алкілування ведуть в присутності співкаталізатора – сульфатної кислоти, хлористого алюмінію при 30-40°С і тиску до 7атм. Газофазне алкілування проводять на фосфорнокислому каталізаторі сумішшю бензен: пропан: пропен 8:2:1 при 250-300°С, в присутності водяної пари.
11.2. N-алкілування ароматичних амінів
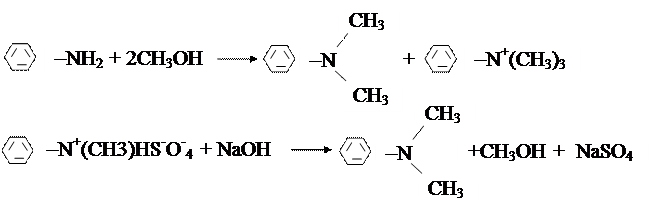 Алкілування ароматичних амінів приводить до жирноароматичних амінів. Так з первинних ароматичних амінів при алкілуванні можуть бути отримані вторинні і третинні жирноароматичні аміни.
Алкілування ароматичних амінів приводить до жирноароматичних амінів. Так з первинних ароматичних амінів при алкілуванні можуть бути отримані вторинні і третинні жирноароматичні аміни.
Алкілування ароматичних амінів спиртами проводять з добавкою невеликої кількості кислих агентів (мінеральна кислота, трихлорид фосфору) при 200°С під тиском до 30МПа. Звичайно використовують метиловий і етиловий спирти, мінеральна кислота – соляна або сульфатна 0,05-0,3 молі на моль аміну. Так як введення води небажане, тоді замість соляної кислоти використовують гідрохлориди амінів.
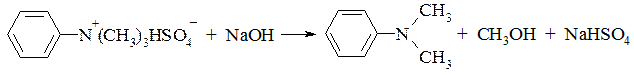
Реакцію важко зупинити на певній стадії. Збільшуючи кількість вихідного спирту вдається зсунути рівновагу в сторону утворення третинного аміна і четвертичної амонієвої основи. Так для отримання N,N-диметиланіліна використовують 3-4 молі метилового спирту, добавляють 0,1-2 молі сульфатної кислоти, реакцію ведуть при 205-215°С і тиску 3МПа. В цих умовах утворюється також сіль четвертинної амонієвої основи і в незначній кількості N-метиланілін.
Для перетворення солі амонієвої основи в цільовий продукт, реакційну масу обробляють лугом і нагрівають до 130-170°С. Сіль четвертичної амонієвої основи перетворюється в N,N-диметиланілін.

Алкілування простими ефірами проходить в умовах близьких до алкілування спиртами. Введення в аміногрупу гідроксиетильної групи можна здійснити окисом етилену. Етиленоксид вводять в реакційну зону поступово в потоці азоту. Реакцію ведуть при 120-140°С і тиску до 6атм.
Алкілгалогеніди використовують для алкілування амінів в тих випадках, коли останні не можуть бути проалкільовані спиртами або коли алкілгалогеніди більш доступні.
Так при дії етилхлориду на анілін при 190-200°С можна отримати в основному диетиланілін. Додаткова обробка етилбромідом дозволяє отримати диетиланілін, практично вільний від домішку етиланіліну.
За допомогою бензилхлориду в аміногрупу вводять бензильний залишок. Так при дії 1 моля бензилхлориду на 2 молі аніліну при 140°С отримують N-бензиланілін.

11.3 Алкілування фенолів
о-Алкілування фенолів має менше значення ніж алкілування амінів. Це пов’язано з тим, що алкоксигрупу звичайно вводять заміщенням атому хлору, активованого сильною електроноакцепторною групою. Алкілування гідроксигрупи в готових барвниках підвищує їх стійкість до дії розчинів лугу. Так при дії етилхлориду в спиртовому розчині в присутності лугу на барвник Кислотний яскраво жовтий при 120-125°С і 11-13атм отримують Хризофенін.
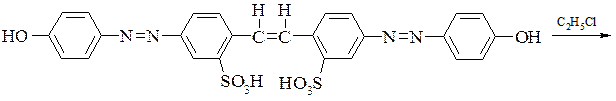

При алкілуванні фенолів в присутності каталізаторів, може одночасно протікати реакція О- і С-алкілування, причому ефіри можуть перегруповуватися в С-алкільні похідні.
Алкілування фенолу олефінами має промислове значення для синтезу п-алкілфенолів – важливої сировини для отримання неіоногенних ПАР, і 2,6-діалкілфенолів – стабілізаторів для полімерних матеріалів. При взаємодії фенолу з ноненом-1 при 100-105°С в присутності катіонних смол утворюється нонілфенол, з якого після оксиетилювання утворюються неоноли.
11.4. Алкілування парафінів
Алкілування парафінів використовують для отримання високооктанового бензину. Найчастіше в якості каталізатора служать сульфатна кислота. Алкілуванню піддають ізобутан, як алкілюючий агент використовують н-бутилени. Реакцію проводять при температурах понад 100°С під тиском. Продуктом реакції є алкілат, збагачений вуглеводнями С8, які часто називають просто ізооктаном.
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- Біогенні аміни та реакції декарбоксилювання
- Види опор та їх реакції
- Визначення реакції продуктів, кислотності і лужності.
- В’язі. Реакції в’язей.
- Гетерогенні реакції.
- Гомогенні реакції.
- Загальні (групові) та індивідуальні (специфічні) аналітичні реакції.
| <== попередня сторінка | | | наступна сторінка ==> |
| Діазотування і перетворення діазосполук | | | Ацилювання. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |