
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Діазотування і перетворення діазосполук
Реакція діазотування має велике практичне і лабораторне значення. Знаходить застосування для синтезу азобарвників і багатьох важливих продуктів.
Реакція відкрита Гріссом в 1858р. Звичайно цю реакцію здійснюють в водному розчині під дією солей нітритної кислоти в присутності мінеральної кислоти

X = Cl, Br, HSO4, NO3
В результаті реакції утворюються водні розчини або суспензії солей діазонія. Солі діазонія реакційноздатні продукти і можуть вступати в різноманітні реакції. Зберігати солі діазонія можна тільки нетривалий час при охолодженні.
Реакцію діазотування звичайно проводять при низьких температурах (0-5°С); в деяких випадках реакцію проводять при дещо підвищеній температурі (20-40°С). Отримані розчини діазосполук відразу направляють для подальшого використання. Крім розчинів можуть використовуватись суспензії і, рідко, вологі пасти. Це зв’язано з тим, що в сухому вигляді солі діазонія нестабільні і надзвичайно вибухонебезпечні. В певних умовах можна отримати стійкі форми діазосполук.
При діазотуванні на 1 моль ароматичного аміна використовується 1 моль нітриту натрію. Ця реакція протікає кількісно, тому використовують для кількісного визначення ароматичних аміносполук. Кількість кислоти звичайно складає 2,25-2,5 молі на моль аміну. Надлишок мінеральної кислоти необхідний для того, щоб запобігти утворенню діазоаміносполук, які можуть утворюватися при взаємодії солі діазонія з вільним вихідним аміном
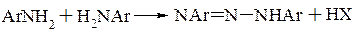
При збільшенні надлишку мінеральної кислоти зростає стабільність діазосполук. Великий надлишок кислоти необхідний при діазотуванні таких ароматичних сполук, які здатні до реакції самоазосполучення.
Звичайно використовують такий порядок діазотування: до розчину або суспензії ароматичного аміна в розведеній мінеральній кислоті при охолодженні і перемішуванні прибавляють розчин нітриту натрію. В кінці діазотування повинен бути невеликий надлишок нітритної кислоти, який визначається по темно-синьому забарвленню йодкрохмального паперу. Надлишок нітритної кислоти збільшує стабільність діазосполук, його знімають безпосередньо перед використанням діазосолі. Для зняття надлишку використовують сульфамінову кислоту або карбамід


Ароматичні аміносульфокислоти, які звичайно нерозчинні в мінеральних кислотах, попередньо переосаджують з водного розчину лугу, а потім прибавляють надлишок мінеральної кислоти, щоб осадити аміносульфокислоту в дрібнодисперсному вигляді. Стадія отримання аміну в дрібнодисперсному вигляді використовується практично для всіх амінів, зрозуміло, крім тих, що добре розчиняються в розбавлених мінеральних кислотах.
В деяких випадках використовують зворотній порядок діазотування, коли ароматичний амін разом з розчином нітриту натрію виливають на мінеральну кислоту. Слабоосновні ароматичні аміни – полінітро-, поліхлораніліни – діазотуються в середовищі концентрованої сульфатної кислоти при дії нітрозилсульфатної кислоти. Якщо основність аміну підвищена або амін розкладається під дією мінеральної кислоти, то його сіль розчиняють в органічному розчиннику і при охолодженні обробляють таким м’яким нітрозуючим агентом, як алкілнітрит.
10.1. Кислотно-основні перетворення діазоній катіону
Особливість ароматичних діазосполук пов’язана з виключною різноманітністю різноманітних перетворень, які виникають при взаємодії солі діазонію з основами. В результаті такої взаємодії утворюються дві ковалентні ізомерні форми, що різко розрізняються по своїм властивостях.
Якщо в якості основи, з якою взаємодіє сіль діазонію, є гідроксид-аніон (перетворення в водному середовищі), тоді двома ізомерними діазоформами є діазогідроксиди. Останні здатні дисоціювати з утворенням двох ізомерних діазотат-аніонів.
На чолі схеми перетворень діазосполук стоїть діазоній-катіон (I) - єдина частинка, яка здатна вступати в реакцію азосполучення. Діазоній-катіон взаємодії з гідроксид-аніоном, зворотно утворює Z-діазогідроксид (II), який дисоціюючи як кислота переходить в Z-діазотат-аніон (III). Останній поволі ізомеризується в E-діазотат-аніон (IV). Зворотній перехід E-Z проходить при фотоопромінюванні, темнова реакція протікає дуже повільно.
При дії слабких кислот на E-діазотат-аніон утворюється Е-діазогідроксид (V), який може ізомеризуватися в N-нітрозоамін (VI). При подальшому підкисленні Е-діазогідроксиду утворюється діазоній-катіон. Діазоній катіон може вступати в реакцію з Z-діазотат-аніоном з утворенням діазоангідриду.

10.2. Хімічні перетворення діазосполук
Діазосполуки надзвичайно реакційноздатні продукти. Вони здатні до двох видів перетворень: реакції без виділення азоту з утворенням азотовмісних продуктів і реакції з виділенням азоту, в ході який діазогрупа заміщається на інший замісник. З реакцій першої групи важливими є реакції азосполучення і реакції відновлення з утворенням арилгідразинів. До другої групи реакцій відносяться реакції заміщення діазогрупи на атом водню, галогену, гідроксильної і ціангрупи, арильним залишком, сірковмісними продуктами.
10.2.1. Реакція азосполучення
Солі діазонію – електрофільні реагенти – здатні вступати в реакцію з ароматичними сполуками, як правило, що мають високу основність (аміни, феноли), з аніонами сильних СН-кислот (малонового і ацетооцтового ефіру, аліфатичних нітросполук, а також з олефінами (дивінілом, ізобутиленом, вініловими ефірами і т.д.)).
Реакція пришвидшується, коли в діазокомпоненті присутні електроноакцепторні групи, особливо в о- і п-положеннях, і, навпаки, присутність в діазоскладовій електронодонорних груп приводить до сповільнення реакції. Для прикладу п-нітробензендіазоній реагує в 1300 разів швидше ніж бензендіазоній, а п-метоксибензендіазоній в 100 разів повільніше ніж бензендіазоній.
Звичайно діазоній катіон при взаємодії з азоскладовими бензеньного ряду атакує пара-положення. Коли пара-положення зайняте групою СООН або SO3H при азосполученні вони можуть відщеплюватися. α-Нафтоли сполучаються в положення 4, а якщо воно зайняте, в положення 2. β-Нафтоли сполучаються тільки в положення 1. Якщо 1 положення зайняте групами СООН, SO3H, NHCH3, Cl, то вони можуть заміщуватися азогрупою.
Реакцію азосполучення проводять в середовищі, близькому до нейтрального. Якщо в якості азоскладової використовують амін, оптимальне значення рН знаходиться в інтервалі 5-8. Величина рН менше 5 небажана по тій причині, що в цих умовах аміни утворюють солі, катіони яких не мають електронодонорних властивостей. При рН вище 9 сполучення проводити теж небажано, так як в цих умовах може утворюватися діазотат-аніон, який не вступає в азосполучення.
Для фенолів оптимальним значенням рН є область 9-10. Реакція азосполучення значно швидше проходить з фенолят-аніоном, чим з фенолом.
Якщо в азоскладовій присутні і аміно- і гідроксигрупа в залежності від рН середовища вдається провести азосполучення тільки по одній з груп. Як приклад Аш-кислота.
В результаті азосполучення отримують яскраво забарвлені сполуки, які використовуються як барвники.
При проведенні азосполучення, як правило, використовуються еквімолярні кількості азо- і діазоскладової, так як надлишок однієї з них може значно погіршити колористичні характеристики барвника.
10.2.2. Відновлення діазосполук з утворенням арилгідразинів
Арилгідразини отримують при дії на солі діазонію різних відновників.

Хороші результати отримують при використанні хлориду олова (ІІ) (2-2,5 молі на моль діазосполуки), однак метод неекономічний. Звичайно для отримання арилгідразинів сіль діазонія обробляють солями сірчистої кислоти, краще сумішшю сульфіту і бісульфіту натрію.
В промисловості таким методом отримують фенілгідразін, 4-гідразінобензен-1-сульфокислоту і 5гідразіно-2-феноксибензен-1-сульфо-кислоту, які використовуються для синтезу піразолонів.
10.2.3. Заміщення діазогрупи на водень і алкоксигрупу
Заміну діазогрупи на водень здійснюють при обробці солі діазонія великою кількістю спирту. Заміщення діазогрупи атомом водню має практичне значення при необхідності отримати речовини, синтез яких неможливий іншими шляхами, наприклад 5-нітро-метаксилол або 3-гідросинафтален-1-сульфокислоту:
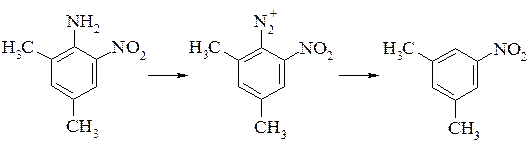
Заміна діазогрупи на водень і алкоксигрупу протікає конкурентно при взаємодії діазосполуки зі спиртами. Напрямок реакції залежить від умов проведення синтезу і від природи спирту. Зі збільшенням довжини R спирту збільшується заміщення воднем. Так в метанолі утворюється до 93% метоксипохідного, етанолі – 60%, аміловому спирті – 30%. Підкислення реакційної маси приводить до збільшення виходу алкоксипохідного. Проведення заміщення в ацетатному буфері приводить до зростання виходу воденьзаміщених продуктів. Ініціювання реакції відновниками або окислювачами теж збільшує вихід заміщення воднем.
10.2.4. Заміщення діазогрупи гідроксигрупою
Для перетворення діазосполуки в гідроксипохідне попередньо ароматичний амін діазотують в розчині сульфатної кислоти і потім водний розчин діазосполуки нагрівають до кипіння. При цьому гідросульфат діазонію розкладається до гідроксисполуки.
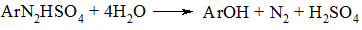
Для отримання фенолу в лабораторних умовах рекомендується поступово вводити розчин солі діазонію в надлишкову кількість нагрітої розбавленої сульфатної кислоти, а не просто нагрівати їх суміш, так як в такому випадку можливе азосполучення фенолу з діазоній-катіоном.
При діазотуванні і наступному розкладі діазосполук необхідно уникати присутності галогенводневих кислот, так як в протилежному випадку можливе утворення галогенпохідних.
При розкладі розчину діазосполуки, яку отримують при діазотуванні сульфату аніліну, можливе утворення п-нітрозофенолу, при окисленні якого утворюються діазосмоли.

Тому після закінчення діазотування необхідно зняти надлишок нітритної кислоти і вести неперервну відгонку гідроксисполуки.
Методи заміщення діазогрупи гідроксигрупою дозволяють отримати саліцилову кислоту, 5-нітро-о-крезол (2-гідрокси-4-нітротолуен), п-крезол.
10.2.5. Заміщення діазогрупи атомом галогену
Найбільше значення має заміна діазогрупи атомом хлору. Таким чином в промисловості вдається отримати ряд хлорзаміщених, які отримати іншим шляхом не вдається.
Звичайно обмін діазогрупи на атом галогену здійснюють за допомогою реакції Зандмейєра – взаємодією солей діазонія з галогенідом міді (I) в формі комплексного аніона, наприклад CuCl2–, який утворюється по реакції

рівновага в водному розчині практично зсунута вправо.
На практиці цю реакцію здійснюють, прибавляючи розчин солі діазонію в розчин галогеніду міді (I) в відповідній галогенводневій кислоті. На 1 моль діазосполуки використовують 0,2-0,3 молі галогеніду міді. Реакцію звичайно проводять при 50-80°С. Таким чином отримують м-хлортолуен, 2,6-дихлортолуен, а також 8-хлорнафтален-1-сульфокислоту.
Різновидністю реакція Зандмейєра є реакція Гаттермана, коли в якості каталізатора використовують свіжоприготовлений порошок міді, що отримують відновленням цинковим порохом мідного купоросу. Реакцію заміщення проводять при 50°С. Виходи по реакції Гаттермана дещо нижчі ніж по реакції Зандмейєра.
Реакції Зандмейєра і Гаттермана дозволяють провести заміщення діазогрупи на хлор, бром, ціан- і нітрогрупу. В аналогічних умовах при дії сірчистої кислоти утворюються сульфінові кислоти.
При термічному розкладі сухих борфторидів діазонія по реакції Шимана вдається замінити діазогрупу на атом фтору. Реакція проходить при нагріванні в межах 100-150°С.
Нагрів солей діазосполук в присутності йодистого калію навіть при відсутності міді або її солей приводить до утворення йод похідних.
10.2.6. Заміщення діазогрупи арильним залишком.
При обробці діазосполук деякими відновниками проходить відщеплення молекули азоту з виникненням зв’язку С–С між двома залишками ароматичної сполуки і утворення симетричних біарилів.
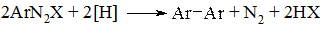
На практиці використовують в якості відновника аміачний розчин оксиду міді (I) (з розрахунку 1 моль Cu2O на 1 моль діазосолі) при кімнатній температурі або сульфат міді (I) в аміаці. Таким чином отримують технічно важливу 1,1-бінафтіл-8,8-дикарбонову кислоту. Заміщення проходить як радикальний процес з переносом електрону.
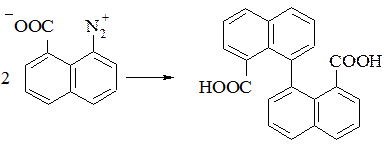
За допомогою діазосполуки можна ввести в ароматичне кільце інший арильний залишок, що дозволяє отримати несиметричні біарили. Для проведення цієї реакції доцільно використовувати діазосполуку у вигляді подвійної солі з ароматичними сульфокислотами або хлоридом цинку. При наявності замісника в молекулі ArH арильний залишок вступає переважно в пара-положення, незалежно від природи замісника. Наприклад при взаємодії діазобензену з нітробензеном утворюється 4-нітробіфеніл
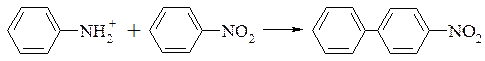
Діаріли можна отримати конденсацією солей діазонія з ароматичними або гетероциклічними сполуками під дією водного лугу (реакція Гомберга). Для проведення цієї реакції вводять розчин лугу в суміш солі діазонію з великим надлишком ароматичної сполуки.
10.2.7. Діазосполуки аліфатичного ряду
При дії нітритної кислоти на первинні аліфатичні аміни затриматися на стадії солі діазонію не вдається. Однак діазосполуки аліфатичного ряду все-таки можуть існувати у вигляді біполярних молекул, в яких від’ємний заряд делокалізований між двома атомами, які ковалентно зв’язані з третім, зарядженим позитивно, атомом азоту.
Простішим представником діазосполук аліфатичного ряду є діазометан. Для отримання таких діазосполук доводиться використовувати обхідний метод отримання: нітрозують ацильований первинний аліфатичний амін і ацилнітрозоалкіламін піддають лужному розщепленню. Як проміжний продукт утворюється діазотат, який розпадається до діазоалкілу

Для отримання діазометану найбільш зручними є нітрозоалкілсечовини, нітрозоалкілтолуенсульфаміди
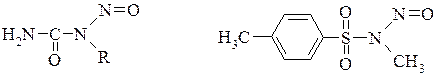
Синтез проводять при обробці на холоду (до 5°С) нітрозометилсечовини їдким калієм в ефірі.
Діазометан надзвичайно реакційноздатний продукт. Легко реагує як з нуклеофілами утворюючи ковалентний зв’язок з атомом вуглецю карбонільної групи. При атаці діазометаном вуглецю карбонільної групи утворюється біполярний іон, а надалі проходить відщеплення азоту
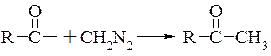
При взаємодії альдегідів з діазометаном утворюються метилкетони. При взаємодії діазометану з хлорангідридами кислот проходить відщеплення хлористого водню, а не азоту, з утворенням діазокетонів. Діазокетони при нагріванні вище 100°С зазнають перегрупування Вольфа з утворенням кислоти, яка має на один атом вуглецю більше чим вихідний хлорангідрид.
Читайте також:
- Адаптивні хвилькові перетворення : Хвилькові пакети.
- Визначення перетворення за Лапласом
- Визначення. Матриці, отримані в результаті елементарного перетворення, називаються еквівалентними.
- Визначте соціальні перетворення в процесі радянізації українського суспільства.
- Виконаємо лінійне перетворення
- Вимірювальні сигнали, перетворення вимірювальних сигналів, форми вимірювальної інформації
- Вирішення проблеми не міститься в існуючому знанні та не може бути отримане шляхом перетворення наявної наукової інформації.
- Вирішення проблеми не міститься в існуючому знанні та не може бути отримане шляхом перетворення наявної наукової інформації.
- Властивості зворотного перетворення за Лапласом
- Властивості прямого перетворення за Лапласом
- Вплив легуючих елементів на перетворення в сталі
- Встановлення комуністичного політичного режиму в Україні в 20-х – 30-х роках ХХ ст.: соціально-економічні перетворення
| <== попередня сторінка | | | наступна сторінка ==> |
| Взаємне заміщення аміно- і гідроксисполук | | | Реакції алкілування |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |