
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Окислення.
Введення кисню в молекулу органічної сполуки або видалення атому водню, часто супроводжується заміщенням на кисень. Процеси окислення органічних сполук протікають в результаті заміщення, приєднання або відщеплення.
– заміщення водню або інших атомів на кисень


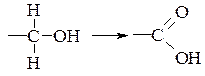

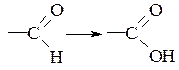
Окислення активованої метиленової або метильної групи в карбонільну під дією двооксиду селену називають реакцією Райлі
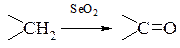
– приєднання по подвійному вуглець-вуглецевому зв’язку з утворенням зв’язку вуглець-кисень і приєднанням кисню до атому з перемінною валентністю
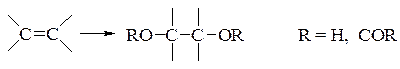
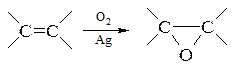
– відщеплення водню з утворенням кратного зв’язку між елементами
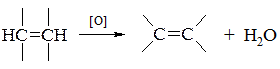

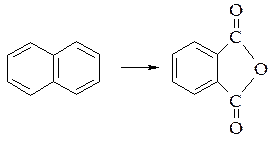
Реакції окислення можна розділити на ті, що проходять з руйнуванням вуглецевого скелету молекули, і на ті, що проходять без руйнування. До першої групи відносяться реакції окислення, які протікають з руйнуванням вуглецевого скелету і зменшенням кількості атомів вуглецю в сполуці або реакції, що протікають з розривом зв’язку вуглець-вуглець, але без зміни числа атомів вуглецю. Так при окисленні нафталену до фталевого ангідриду проходить руйнування зв’язку С-С і зменшення числа атомів вуглецю, а при окисленні аценафтена з утворенням нафталендикарбонової-1,8-кислоти проходить розрив зв’язку С-С, але кількість атомів вуглецю залишається без змін.
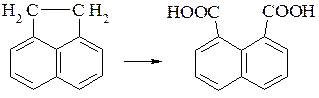
До другої групи реакцій відносяться перетворення сполук, які пов’язані з введенням в них атому кисню: утворення гідроксигрупи, відщеплення атомів водню.
В якості окислювачів частіше всього використовують неорганічні сполуки (біхромат калію, перманганат калію, оксид марганцю (ІV), хлорид заліза (ІІІ), азотну кислоту, перекис водню і т.д.). В деяких випадках в якості окислювачів можуть використовуватись і органічні кисневмісні сполуки (наприклад, нітросполуки). В багатотоннажних виробництвах окислення проводять під дією кисню повітря на каталізаторах.
Всі реакції окислення, як правило, незворотні. В деяких випадках вдається здійснити зворотні реакції, як у випадку кубових барвників. В процесах окислення виділяється велика кількість тепла. Так при окисленні толуену до бензойної кислоти киснем повітря виділяється 567,4 кДж/моль, а при окисленні нафталену до фталевого ангідриду 1807 кДж/моль і до малеїнового ангідриду 3655 кДж/моль тепла. Тепловий ефект реакції окислення зростає при підвищенні глибини окислення; при повному згорянні нафталену до двоокису вуглецю кількість тепла складає 5152 кДж/моль. Виділення під час реакції великої кількості тепла вимагає створення доброго теплообміну при здійсненні технологічного процесу.
13.1. Реакції окислення зі збереженням вуглецевого скелету
Серед реакцій окислення, які проходять без руйнування вуглецевого скелету молекули, найбільше значення має окислення метильної групи в ароматичних сполуках з утворенням відповідного ароматичного альдегіду або ароматичної кислоти.
Для окислення метильної групи до альдегідної використовують м’які окислювачі – кисневмісні сполуки марганцю: MnO2 в водній сірчаній кислоті (температури до 40°С) або в концентрованій сірчаній кислоті, сульфат марганцю (III). При окисленні толуен-2,4-дисульфокислоти Mn2(SO4)3 в концентрованій сірчаній кислоті при 60-120°С отримують 4-формілбензен-1,3-дисульфокислоту (бензальдегід-2,4-дисульфокислоту), яка є вихідним продуктом для синтезу трифенілметанових барвників.

Утворення альдегідної групи проходить гладко при окисленні сполук з хлорметильною групою CH2Cl. В якості окислювача в цьому випадку використовують біхромат натрію або калію в лужному середовищі. Так, при кип’ятінні бензилхлориду з водним розчином біхромату натрію в середовищі лугу утворюється бензальдегід, який відганяють з реакційної маси з водяною парою і очищують через бісульфітну сполуку. Для перетворення хлорметильної групи в альдегідну зручно використовувати гексаметилентетрамін (уротропін).
При окисленні метильної групи до карбоксильної використовують більш сильні окислювачі: біхромат натрію, перманганат калію, азотну кислоту.
Для отримання ряду ароматичних кислот використовують біхромат натрію в середовищі розбавленої сульфатної кислоти. Так, наприклад, отримують п-нітробензойну кислоту і 1-нітроантрахінонкарбонову-2-кислоту.
Перманганат калію в якості окислювача використовується рідко, так як він більш дорогий. Окислення звичайно проводять при кип’ятінні водного розчину, в нейтральному або лужному середовищі. Таким чином з м-ксилолу отримують бензендикарбонову-1,3-кислоту (ізофталеву).
Для отримання ароматичних карбонових кислот виявляє інтерес окислення в рідкій фазі алкілароматичних вуглеводнів киснем повітря при 130-200°С в присутності солей металів перемінної валентності, частіше всього нафтенату кобальту. Реакція протікає по радикальному механізму. Так окисленням в рідкій фазі толуену киснево-повітряною сумішшю при атмосферному тиску або повітрям при тиску 6ат при 160-180°С в присутності каталізатора (карбонат марганцю або кобальту в суміші з бромідом натрію) отримують бензойну кислоту. При окисленні п-ксилолу в тих же умовах окислюється тільки одна метильна група і утворюється п-толуїнова кислота (п-метилбензойна кислота).
В більш жорстких умовах (260-280°С, 70атм) можна окислити і другу метильну групу, але вихід терефталевої кислоти при цьому не перевищує 60%. Але якщо, групу СООН, що утворилася, перевести в складноефірну групу, тоді її дезактивуюча дія знімається. На цій основі був розроблений метод отримання диметилового ефіру терефталевої кислоти окисленням п-ксилолу в п-толуїлову кислоту, етерифікацію метиловим спиртом, окисленням і повторною етерифікацією до диметилтерефталата.


Як виявилось, цей процес можна провести в одну стадію, без проміжного отримання п-толуїлової кислоти. Для цього окислення п-ксилолу проводять з використанням оцтової кислоти, каталізатора – солей кобальту і марганцю – і бромідів лужних металів. Окислення проводять при 150°С і тиску до 40атм.
13.2. Реакції окислення зі зміною вуглецевого скелету молекули.
При окисленні моноаміда фталевої кислоти гіпохлоритом або гіпобромідом натрію в лужному середовищі утворюється 2-амінобензойна (антранілова) кислота. Реакція проходить з розривом вуглець-вуглецевого зв’язку з виділенням двоокису вуглецю.

Моноамід фталевої кислоти отримують гідратацією фталіміда або при дії водного аміаку на фталевий ангідрид.
Руйнування зв’язку С-С з відщепленням СО2 в карбонових кислотах може проходити і в присутності окислювача. Прикладом такого перетворення є отримання з фталевого ангідриду бензойної кислоти. Утворення бензойної кислоти проходить при каталітичному декарбоксилуванню фталевого ангідриду в паровій фазі, для чого суміш парів фталевого ангідриду і води пропускають при 330-400°С над каталізатором (карбонат кальцію, окис алюмінію і т.п.). Необхідно відмітити, що бензойна кислота, яку отримують з фталевого ангідриду, відрізняється високою чистотою.
13.2.1. Отримання гідроксисполук
Великий практичний інтерес виявляє реакція окислення алкілароматичних вуглеводнів до гідропероксидів з наступним розривом зв’язку вуглець-вуглець і заміщенням алкільної групи гідроксигрупою. Ця реакція лежить в основі кумольного методу отримання фенолу.
Ізопропілбензен окислюють киснем повітря при 105-120°С. В результаті багатократної ректифікації отримують α,α-диметилбензилгідропероксид з концентрацією 88-92%. Розклад гідропероксиду проводять при 50-60°С в присутності 0,05-1% (мас) сульфатної кислоти. Швидкість розкладу достатньо велика; при цьому виділяється велика кількість тепла. Після нейтралізації і ректифікації отримують товарний фенол і ацетон.

На даний час кумольний метод є основним при синтезі фенолу. Перевагою даного методу є малий розхід і доступність вихідної сировини, невелика кількість відходів, одночасне отримання двох цінних продуктів.
Аналогічно, окисленням і наступним розкладом гідропероксидів отримують п-крезол і резорцин.
13.2.2. Гетерогенно-каталітичне окислення в паровій фазі
Серед реакцій окислення велике практичне значення має реакція парофазного гетерогенно-каталітичного окислення. Ця реакція лежить в основі отримання таких важливих продуктів, як фталевий ангідрид, малеїновий ангідрид і антрахінон.
Фталевий ангідрид отримують парофазним каталітичним окисленням нафталену киснем повітря. Реакцію проводять при 325-450°С над каталізатором, який містить окис ванадію. Крім фталевого ангідриду утворюється 1,4-нафтохінон і малеїновий ангідрид.
Через дефіцит нафталену останнім часом все більше застосування знаходить окислення о-ксилолу. Метод отримання аналогічний окисленню нафталену.
Каталітичним окисленням в паровій фазі отримують малеїновий ангідрид з бензену по реакції
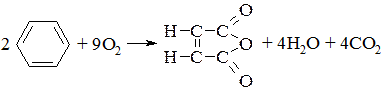
13.2.3. Окислення первинних, вторинних спиртів і альдегідів
Первинні і вторинні спирти легко реагують з окислювачами, в той же час третинні спирти окисляються важко, причому проходить розрив С-С зв’язку.
В якості окислювачів використовують хромову кислоту, суміш біхромату з сірчаною кислотою, азотну кислоту, двоокис марганцю і двоокис селену.
При окисленні первинних спиртів, альдегід який утворюється в реакції, необхідно захищати від подальшого окислення. Його можна, наприклад, видаляти з реакційної маси безперервною відгонкою, що можливо, оскільки точки кипіння альдегідів нижчі, ніж у відповідних спиртів. Виходи при біхроматному окисленні рідко перевищують 60%. Необхідно відмітити, що при правильному веденні реакції кратні С=С зв’язки майже не реагують.
Більш високі виходи альдегіду отримують при окисленні первинних спиртів трет-бутилхроматом (в петролейному ефірі, бензені або чотирьохлористому вуглеці) і двоокисом марганцю (в петролейному ефірі, ацетоні або розбавленій сірчаній кислоті). З цими реактивами можна отримати також з хорошими виходами ненасичені і ароматичні альдегіди.
Реакцію окислення проводять при температурі 25°С.
Окислення вторинних спиртів до кетонів вдається краще, ніж окислення первинних спиртів, і дає вищі виходи, так як по-перше реакційна здатність вторинних спиртів вища, а, по-друге кетони більш стабільні до дії окислювачів ніж альдегіди.
При окисленні первинних спиртів до карбонових кислот в кислому розчині, альдегіди які утворюються як проміжні продукти, можуть етерифікувати кислоти, в зв’язку з чим частина спирту не окислюється. Через це первинні спирти краще окислюються перманганатом натрію в лужному середовищі.
| <== попередня сторінка | | | наступна сторінка ==> |
| Ацилювання. | | | Реакції конденсації |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |