
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Ацетати целюлози
[C6H7O2(OH)3]n + 3n СН3СООН → [C6H7O2(OСОСН3)3]n + 3n H2O
триацетат целюлози
Ацетати целюлози – штучне волокно.
· Біологічна роль:
1 –стимулює моторику шлунку та кишечнику, виділення травних соків, створює відчуття ситості;
2 –виводить з кишково – шлункового тракту барвники, важкі метали
та радіоактивні елементи, що попадають туди з їжею;
3 –переварювання клітковини відбувається в товстому кишечнику під
дією ферменту целюлаза, але цей процес йде тільки на 10%, тому клітковина
приймає участь в утворенні калу.
Використання вуглеводів у медицині
· Глюкозає енергетичним „паливом” для організму. Це необхідний компонент крові, її вміст у крові людини становить 80 – 100 мг в 100 мл. Коли вміст глюкози у крові стає більше 180 мг, порушується вуглеводний обмін, виникає цукровий діабет.
У зв’язку з тим, що глюкоза легко і швидко засвоюється, її застосовують як засіб посиленого харчування, а також для виготовлення лікувальних препаратів і при консервуванні крові.
· Фруктоза –найкращий вид цукру для хворих атеросклерозом, при порушенні в організмі обміну жирів.
· Сахароза –використовується для виготовлення сиропів, мікстур для дітей.
· Лактоза –відрізняється від решти цукрів відсутністю гігроскопічності й тому використовується для приготування порошків. Входить до складу сумішей для дитячого дієтичного харчування.
· Сорбіт: –замінник цукру для хворих на цукровий діабет;
– стимулятор виділення жовчі при дуодентальному зондуванні.
· Глюконат кальцію – джерело кальцію в організмі. Також використовують як антиалергічний та кровоспинний засіб.
· Крохмаль– для виготовлення мазей, присипок.
· Колоксилін– для виготовлення рентгенівської плівки.
· Колодій– для закріплення пов’язок.
Аміни
· це похідні аміаку, в якому 1, 2 або 3 атома Н заміщені на радикали:
Ø первинні аміни R – NH2
Ø вторинні аміни R – NH – R
Ø третинні аміни R – N – R
׀
R
Номенклатура амінів:
СН3 – NH2 метиламін СН3 – СН2 – СН – СН3
С2Н5 – NH2 етиламін ׀
С3Н7 – NH2 пропіламін NH2 2 – амінобутан
СН3 – NH – СН3 диметиламін
СН3 – NH – С2Н5 етилметиламін (радикали називають в алфавітному порядку)
Добування амінів: +HNO3 +3H2
· первинні аміни:СН4 → СН3 – NО2 → СН3 – NH2
–H2O –2H2O
+Cl2 +NH3
СН4 → СН3 – Cl → СН3 – NH2
–HCl –HCl
· вторинні аміни:СН3 – NH2 + Cl – CH3 → СН3 – NH – СН3 + HCl
· третинні аміни: СН3 – NH – СН3 + Cl – CH3 → СН3 – N – СН3 + HCl
׀
СН3
Порівняльна характеристика основності аміаку та амінів:
Аміак виявляє основні властивості за рахунок неподіленої пари електронів атома N:
Н Н
| |
|
Н – N: + H+ → H – N H+
׀
H
Аміни виявляють більш сильні основні властивості під впливом радикалів:
Н Н СН3
׀ ׀ ↓
СН3 → N: СН3 → N: СН3 → N:
׀ ↑ ↑
H CH3 CH3
 Ароматичні аміни виявляють більш слабкі основні властивості, тому що пара електронів взаємодіє з π – хмарою бензольного кільця:
Ароматичні аміни виявляють більш слабкі основні властивості, тому що пара електронів взаємодіє з π – хмарою бензольного кільця:
Н

 ׀
׀
– N:
׀
Н
Фізичні властивості:
Метил – та етиламіни – газоподібні, інші аміни та анілін – рідкі з характерним запахом аміаку. Вищі аміни – тверді.
 Хімічні властивості ациклічних амінів:
Хімічні властивості ациклічних амінів:
· горіння:
4СН3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
· взаємодія з водою:
СН3NH2 + НОН → [СН3NH3]OH гідроксид метиламонію
· взаємодія з неорганічними кислотами:
СН3NH2 + НCl → [СН3NH3]Cl хлорид метиламонію
· алкілування:
СН3NH2 + CH3Cl → CH3 – NH – CH3 + HCl
· 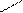
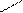
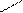
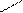 ацилювання:О О
ацилювання:О О
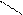
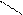 СН3NH2 + СН3 – С → СН3 – С + Н2О
СН3NH2 + СН3 – С → СН3 – С + Н2О
ОН NH – СН3 метиламід оцтової
кислоти
· взаємодія з HNO2:
первинні аміниСН3NH2 + HNO2 → CH3OH + N2 + H2O
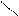
 вторинні аміниR R
вторинні аміниR R
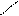
 NH + HO – N = O → N – N = O + H2O
NH + HO – N = O → N – N = O + H2O
R R
третинні аміни– не взаємодіють
 Хімічні властивості аніліну:
Хімічні властивості аніліну:
· горіння:
4С6Н5NH2 + 31O2 → 24CO2 + 14H2O + 2N2
· з водою не взаємодіє(більш слабкі основні властивості)
· взаємодія з неорганічними кислотами:
С6Н5NH2 + НCl → [С6Н5NH3]Cl хлорид феніламонію
· алкілування:
С6Н5NH2 + CH3Cl → C6H5 – NH – CH3 + HCl
· 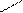
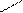
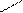
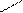 ацилювання:О О
ацилювання:О О
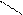
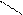 С6Н5NH2 + СН3 – С → СН3 – С + Н2О
С6Н5NH2 + СН3 – С → СН3 – С + Н2О
ОН NH – С6Н5 ацетанілід
· взаємодія з HNO2– утворюються діазосполуки:
 + –
+ –
NH2 N ≡ N Cl

 ׀ ׀
׀ ׀
 |  |
+ NaNO2 + 2HCl → + NaCl + 2H2O
діазоній хлорид
Ця реакція лежить в основі нітритометрії – метод кількісного аналізу для визначення первинних ароматичних амінів.
· реакції бензольного кільця( аміногрупа – орієнтант І роду)
Ø галогенування:
NH2 NH2

 ׀ Br ׀ Br
׀ Br ׀ Br
 |  | ||||||
 |  | ||||||
+3Br2 → + 3HBr
׀
Br
Реакція бромування лежить в основі кількісного визначення первинних
ароматичних амінів.
Ø нітрування:
NH2 NH2

 ׀ ׀
׀ ׀
 |  |
+HNO3 → + H2O
׀
NO2
Ø сульфування:
NH2 NH2

 ׀ ׀
׀ ׀
 |  |
+H2SO4 → + H2O
׀
SO3H
сульфанілова кислота – є основою
сульфаніламідних препаратів
Добування аніліну:
NO2 NH2
· 
 Реакція Зініна:׀׀
Реакція Зініна:׀׀

 + 3H2 → + 2H2O
+ 3H2 → + 2H2O
· Амоноліз:Cl NH2

 ׀׀
׀׀


+ NH3 → + HCl
Лікарські препарати – похідні ароматичних амінів
О
׀׀
NH – C – CH3
 ׀
׀

ацетанілід (антифебрин)– жарознижуючий засіб
О
׀׀
NH – C – CH3
 ׀
׀

парацетамол– жарознижуючий та знеболюючий засіб
׀
ОН
О
׀׀
NH – C – CH3
 ׀
׀

фенацетин – жарознижуючий та знеболюючий засіб
׀
О – С2Н5
Кількісне визначення – нітритометрія після гідролізу:
О
 ׀׀ + –
׀׀ + –
NH – C – CH3 NH2 N ≡ N Cl


 ׀׀׀
׀׀׀



HCl + NaNO2 + 2HCl


– CH3COOH – NaCl
׀– 2H2O
R
Сульфаніламідні препарати


Н2N – – SO2 – NH – R


R – НN – – SO2 – NH – R
Мають бактеріостатичну дію. Фармакологічна активність сульфаніламідів пояснюється теорією конкурентного антагонізму. Мікроорганізмам для їх росту необхідна пара – амінобензойна кислота (ПАБК). Сульфаніламіди близькі за будовою до ПАБК:



 О
О
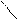 Н2N – – С
Н2N – – С
ОН



 О
О

 R – НN – – S – NH – R
R – НN – – S – NH – R
О
Мікробні клітини використовують сульфаніламіди замість ПАБК, тим самим порушується хід обмінних процесів у мікроорганізмах.


· СтрептоцидН2N – – SО2 – NH2
О

 ׀׀
׀׀
· СульфацилН2N – – SО2 – NH – С – СН3
NH

 ׀׀
׀׀
· СульгинН2N – – SО2 – NH – С – СН3
О

 ׀׀
׀׀
· УросульфанН2N – – SО2 – NH – С – NН2



 N
N
· СульфазинН2N – – SО2 – NH –
N
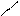 СН3
СН3



 N
N
· СульфадимезинН2N – – SО2 – NH –
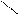 N
N
СН3
Кількісне визначення:
· Нітритометрія
 + –
+ –
NH2 N ≡ N Cl

 ׀ ׀
׀ ׀
 |  |
+ NaNO2 + 2HCl → + NaCl + 2H2O
׀ ׀
R R
· Броматометрія
KBrO3 + 5KBr + 6HCl → 3Br2 + 6KCl + 3H2O
NH2 NH2

 ׀ Br ׀ Br
׀ Br ׀ Br
 |  | ||||||
 |  | ||||||
+2Br2 → + 2HBr
׀ ׀
R R
Br2 + 2KI → I2 + 2KBr
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Амінокислоти
· це органічні сполуки, що містять одночасно карбоксильну та аміногрупу.
СН2 – СООН амінооцтова кислота
׀
NH2 α β γ
CH3 – CH2 – CH – COOH CH3 – CH – CH2 – COOH CH2 – CH2 – CH2 – COOH
׀ ׀ ׀
NH2 NH2 NH2
α – аміномасляна β – аміномасляна γ – аміномасляна
Фізичні властивості:
Тверді речовини, добре розчинні у воді.
Хімічні властивості:
1 – реакції групи NH2
CH2 – COOH + HCl → CH2 – COOH
׀ ׀
NH2 NH3Cl
2 – реакції групи СООН
CH2 – COOH + NaOH → CH2 – COONa + H2O
׀ ׀
NH2 NH2
CH2 – COOH + C2H5OH → CH2 – COOC2H5 + H2O
׀ ׀
NH2 NH2
3 – утворення пептичного зв’язку
|
CH2 – COOH + CH2 – COOH → СH2 – – CH2 – COOH + H2O
׀ ׀ ׀
NH2 NH2 NH2 пептидний зв’язок
Добування :
1 – гідроліз білків – утворюються α – амінокислоти;
2– синтез через галогенокислоти:
+Cl2 +NH3
СН3 – СООН → СН2 – СООН → СН2 – СООН
–HCl׀ –HCl׀
Cl NH2
Відношення амінокислот до нагрівання:
· α – амінокислоти – утворюються пептиди
tº
H2N – CH – COOH + H2N – CH – COOH → H2N – СH – CO – NH – CH – COOH + H2O
׀ ׀ ׀ ׀
CH3 CH3 CH3 CH3
· β – амінокислоти – утворюються ненасичені кислоти
tº
СН3 – СН – СН2 – СООН → СН3 – СН = СН – СООН + NH3
׀
NH2
· γ – амінокислоти – утворюються лактами

 О
О

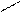
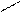
 СН2 – С О
СН2 – С О
 ОН tº СН2 – С
ОН tº СН2 – С
 → ׀ NH + H2O
→ ׀ NH + H2O
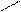 NH2 CH2 – CH
NH2 CH2 – CH
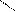
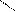 CH2 – CH CH3
CH2 – CH CH3
CH3
α – Амінокислоти
До складу білків входять α – амінокислоти:
|
У складі природних білків містяться 20 різних α – амінокислот. 12 з них синтезуються в організмі. Це замінні амінокислоти. 8 амінокислот повинні поступати з їжею. Це незамінні амінокислоти: валін, лейцин, ізолейцин, лізин, фенілаланін, треонін, триптофан, метіонін.
Класифікація α – амінокислот:
· моноаміно – монокарбонові кислоти –містять одну аміно – та одну карбоксильну групи:
Ø нейтральні амінокислоти
NH2 – CH2 – COOH гліцин NH2 – CH – COOH аланін
׀
СН3
NH2 – CH – COOH фенілаланін NH2 – CH – COOH валін
׀ ׀
СН2 СН – СН3
 ׀ ׀
׀ ׀
 СН3
СН3
NH2 – CH – COOH лейцин NH2 – CH – COOH ізолейцин
׀ ׀
СН2 СН – СН3
׀ ׀
СН – СН3 СН2
׀ ׀
СН3 СН3
NH2 – CH – COOH метіонін
׀
СН2
׀
СН2 – S – CH3
Ø полярні амінокислоти
NH2 – CH – COOH серин NH2 – CH – COOH цистеїн
׀ ׀
СН2 СН2
׀ ׀
ОН SH
NH2 – CH – COOH треонін NH2 – CH – COOH тирозин
׀ ׀
СН – СН3 СН2
 ׀ ׀
׀ ׀
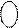 ОН
ОН
׀
ОН
· моноаміно – дикарбонові кислоти(полярні)
NH2 – CH – COOH аспарагінова NH2 – CH – COOH глютамінова
׀ ׀
СН2 СН2
׀ ׀
СООН СН2
׀
СООН
· диаміно – монокарбонові(полярні)
NH2 – CH – COOH аспарагін NH2 – CH – COOH глютамін
׀ ׀
СН2 СН2
׀ ׀
СО – NH2 СН2
׀
СО – NH2
NH2 – CH – COOH лізин NH2 – CH – COOH аргінін
׀ ׀
(СН2)4 (СН2)3
׀ ׀
NH2 NH – C – NH2
׀׀
NH
· гетероциклічні амінокислоти:
Ø  неполярні
неполярні
NH2 – CH – COOH триптофан пролін

 ׀ СООН
׀ СООН



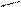

 СН2 N
СН2 N
Н
 | |||
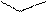 | |||
N
H
Ø полярні NH2 – CH – COOH гістидин

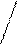
 N׀
N׀
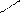 СН2
СН2
N
H
Використання амінокислот у медицині
· γ – Аміномасляна кислота (ГАМК, аміналон) –для лікування нервово – психічних захворювань, при ослабленні пам’яті, порушенні мозкового кровообігу:
NH2 – CH2 – CH2 – CH2 – COOH
· ε – Амінокапронова кислота –кровоспинний засіб:
NH2 – CH2 – CH2 – CH2 – СН2 – СН2 – COOH
· Глютамінова кислота –для лікування психічних захворювань:
НООС – СН2 – СН2 – СН – СООН
׀
NH2
· S – вмісні амінокислоти– для профілактики та лікування променевої хвороби:
HS – CH2 – CH – COOH CH3 – S – CH2 – CH2 – CH – COOH
׀ ׀
NH2 NH2
цистеїн метіонін
Похідні ароматичних амінокислот
|
 |
 пара – амінобензойна кислота
пара – амінобензойна кислота
NH2 NH2

 ׀ ׀
׀ ׀


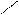 ׀ ׀ C2H5
׀ ׀ C2H5
 COO – C2H5 COO – CH2 – CH2 – N
COO – C2H5 COO – CH2 – CH2 – N
C2H5
анестезин новокаїн
Мають анестезуючу дію.
Білки
· це природні біополімери, що складаються з α – амінокислот.
Будова білків:
· Первинна структура –це певна послідовність амінокислот, зв’язаних
пептидними зв’язками. Первинна будова руйнується
тільки в результаті гідролізу білків.
· Вторинна структура –це спіральна форма поліпептидних ланцюгів,
що утворюється в результаті дії міжмолекулярних
водневих зв’язків.
· Третинна структура –це скручування спіралі в клубок, що утворюється за рахунок водневих зв’язків, дисульфідних містків (між радикалами цистеїну) та гідрофобної взаємодії (між неполярними радикалами амінокислот – валіну, лейцину, ізолейцину, фенілаланіну, триптофану).
· Четвертинна структура –це біологічні комплекси декількох асоційованих
білків (наприклад, молекула гемоглобіну складається з
4 субодиниць, кожна з яких має три попередні
структури).
Властивості білків:
· Форма молекули: –глобулярна (білки крові);
– фібрилярна(білки м’язів, волосся, кісток тощо).
· Заряд молекули –залежить від співвідношення позитивно та негативно заряджених полярних амінокислот та від середовища, в якому знаходиться білок:




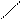


 +OH– OH–
+OH– OH–





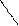

 R R R → R
R R R → R
+H+ → H+
позитивний заряд негативний заряд
Ізоелектрична точка (рІ) – це таке значення рН розчину, при якому білок втрачає свій заряд.
· Розчинність –визначається наявністю двох факторів: водної оболонки та заряду молекули.
· Оборотне осадження –це втрата розчинності:
– висолювання – руйнування водневої оболонки під дією концентрованих розчинів солей лужних металів та амонію;
– зміна рН розчину до рІ – втрата заряду білкової молекули.
Після усунення факторів, що призвели до осадження білка, він знов стає розчинним.
· Необоротне осадження (денатурація) –руйнування у білків вторинної, третинної та четвертинної структури під дією нагрівання, радіації, сильних кислот і лугів, солей важких металів.
· Гідроліз – розклад білків до амінокислот. Відбувається в організмі під дією ферментів – протеаз: пепсин, трипсин, хімотрипсин.
· Кольорові реакції:
Ø біуретова реакція – якісна реакція на пептидні зв’язки. Під дією лугу та кількох крапель розчину CuSO4 утворюється характерне фіолетове забарвлення;
Ø ксантопротеїнова реакція– якісна реакція на ароматичні амінокислоти. При дії на білок концентрованої нітратної кислоти виникає жовте забарвлення, яке при додаванні лугу змінюється на оранжеве.
Біологічна роль білків:
· Структурна функція – білки є будівельним матеріалом клітини.
· Транспортна функція– гемоглобін переносить кисень та вуглекислий газ, ліпопротеїди – жири, трансферази – залізо тощо.
· Енергетична функція– при розкладі білків виділяється енергія, але організм використовує білки як джерело енергії тільки при недостачі жирів та вуглеводів.
· Захисна функція– на дію хвороботворних мікроорганізмів організм відповідає утворенням антитіл, які за своєю природою є білками.
· Каталітична функція– всі реакції в організмі відбуваються за участю ферментів.
· Регуляторна функція– деякі гормони є білками (інсулін, гормони гіпофізу).
Використання білкових речовин у медицині:
· Інсулін– знижує рівень глюкози, використовується при цукровому діабеті.
· Окситоцин –викликає скорочення гладкої мускулатури, особливо мускулатури матки. Використовується в акушерстві та гінекології.
· Антибіотики граміцидин, поліміксин –мають здатність убивати або вибірково пригнічувати ріст збудників захворювань.
Аміди кислот
· це похідні карбонових кислот після заміщення групи ОН на аміногрупу NH2:
|
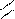 | ||
 |
Добування:



 О O
О O
· 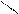
 з карбонових кислотR – C+NH3 →R – C+ H2O
з карбонових кислотR – C+NH3 →R – C+ H2O
OH NH2
· 
 з галогенангідридів кислотО O
з галогенангідридів кислотО O
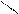
 R – C+NH3 →R – C+ HCl
R – C+NH3 →R – C+ HCl
Cl NH2
· 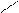
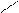
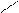
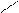 зі складних ефірівО O
зі складних ефірівО O
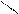
 R – C+NH3 →R – C+ СН3ОН
R – C+NH3 →R – C+ СН3ОН
ОСН3 NH2
Фізичні властивості:
Формамід – рідина, інші аміди – тверді речовини.
Хімічні властивості:
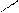
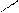
 О O
О O
·  гідроліз
гідроліз R – C+HOH →R – C+ NH3
R – C+HOH →R – C+ NH3
NH2 OH
В амінах та амінокислотах аміногрупа міцно зв’язана і не гідролізується.

 О O
О O
· 
 кислотні властивості2R – C+HgO →R – CHg+ H2O
кислотні властивості2R – C+HgO →R – CHg+ H2O
(слабкі)NH2 NH 2
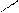
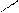
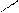
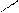 О O
О O
· 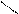
 основні властивостіR – C+HCl →R – C
основні властивостіR – C+HCl →R – C
(слабкі)NH2 NH3Cl
Аміди вугільної кислоти
НО – С – ОН Н2N – C – OH H2N – C – NH2
׀׀ ׀׀ ׀׀
O O O
вугільна кислота карбамінова кислота сечовина
(неповний амід) (повний амід)
· Карбамінова кислота –її складні ефіри називаються уретани:
Н2N – C – O – С2Н5
׀׀
О уретан – снодійний засіб
Читайте також:
| <== попередня сторінка | | | наступна сторінка ==> |
| Крохмаль | | | Сечовина |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |