
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Температури замерзання
Закон Рауля для підвищення температури кипіння і зниження
Усі розчини киплять при більш високій температурі, ніж чисті розчинники, а замерзають при більш низькій температурі. Це пов'язано з тиском пари над розчинам.
Закон Рауля: "Підвищення Dt кипіння розчину і зниження Dt замерзання пряме пропорційні молярній концентрації розчину" :
Dtк = E ∙ C
Dt3 = К ∙ С
де, С - моляльна концентрація, яка виражається кількістю молів розчиненої речовини у 1000 г. розчинника.

де, n - кількість молів розчиненої речовини
L - кількість розчинника

де, Е - ебуліоскопічна постійна величина, яка показує на скільки градусів підвищилась t кипіння розчинника, якщо в ньому присутній 1 моль речовини.

К - кріоскопічна постійна, яка показує на скільки градусів знизиться t замерзання розчинника, якщо у ньому розчинити 1 моль речовини, якщо: n = m / М, то отримаємо:


tk = 100 + Dtk
tз = 0 - Dtз
Визначення молекулярної ваги речовини методами кріоскопії і ебуліоскопії.
1) Якщо кріоскопічна константа К даного розчинника відома, то використовуючи формулу, можна знайти дослідним шляхом молекулярну масу розчинених речовин:

2) Пристрій для кріоскопічних вимірів.
У широкий товстостінний стакан з мішалкою, оточений зверху для термоізоляції ватою, кладуть охолоджену суміш з снігу або льоду і повареної солі. У цю суміш крізь кришку склянки опускають широку пробірку, в яку на пробці встановлюють більш вузьку пробірку, яка має боковий тубус, необхідний для введення наважки досліджуваної речовини. Пробірка закривається пробкою, крізь яку проходять термометр та мішалка.
3) Можна розрахувати молекулярну вагу, використовуючи ебуліоскопічну константу К:
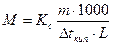
Використовуючи цю формулу, визначають молекулярну вагу розчинених речовин по підвищенню точки кипіння розчину:
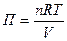 ;
;  ;
;  ;
;  .
.
З цих формул видно, що всі фізичні властивості речовин неелектролітів залежать від кількості молів розчиненої речовини (n), а саме від часткової концентрації розчину, так як по кількості молів розчиненої речовини можливо знайти кількість молекул або часткову концентрацію розчину, яка виражається кількістю частин розчиненої речовини у визначеному об'ємі розчинника.
Читайте також:
- Алгоритм розрахунку температури поверхні чипу ІМС процесора
- Вертикальний градієнт температури
- Визначення температури на поверхні ізоляції принадземномупрокладанні та при прокладанні трубопроводів в приміщенні.
- Вимірювання температури
- Вимірювання температури контактним методом.
- Вплив всесторонннього стиску і температури на механічні властивості гірських порід
- Вплив температури на рівновагу
- Вплив температури на форму та розмір наночастинок
- Добовий та річний хід температури грунту
- Загальні відомості про вимірювання температури
- Закон Планка. Інтенсивність випромінювання чорного тіла й будь-якого реального тіла залежить від термодинамічної температури й довжини хвилі.
- Залежність опору від температури.
Переглядів: 1193
| <== попередня сторінка | | | наступна сторінка ==> |
| Розчинення в розчинах електролітів | | | Константа швидкості реакції в гомогенній системі та гетерогенній. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |