
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Константа швидкості реакції в гомогенній системі та гетерогенній.
Швидкість хімічної реакції.
Хімічна кінетика.
Лекція № 8
Тема:Хімічна кінетика. Швидкість хімічної реакції, хімічна рівновага, принцип Ле-Шательє.
Мета:Вивчити основні поняття хімічної кінетики, навчитися визначати швидкість прямої та зворотної реакції, хімічну рівновагу, користуватися принципом Ле-Шательє, визначати умови перебігу прямої та зворотної реакції.
Сутність хімічної реакції зводиться до розриву зв'язків у вихідних речовинах та виникнення нових зв'язків в продовженні реакції. Утворення зв’язків проходить з виділенням теплоти, розрив з поглинанням теплоти. З швидкістю хімічної реакції пов'язані уявлення про перетворення речовин. Вчення про швидкість хімічної реакції називається хімічною кінетикою.
Під швидкістю хімічної реакції розуміють зміну концентрації одної з реагуючих речовин за одиницю часу при незмінному об'ємі системи. Розглянемо в загальному вигляді:
А + В = С + Д
С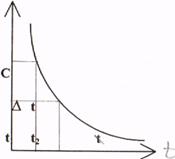
С1
D
С2
V=(DC/ Dt)
Швидкість реакції може бути визначена лише для деякого проміжку часу. Оскільки концентрація речовини А у момент часу t1 вимірюється величиною С1, а у момент t2 величиною С2, то за проміжок як Dt = t1 -t2, зміна концентрації речовини складе DС = С1 – С2.
Середня швидкість реакції:
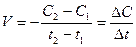
Практика показує, що при збільшенні концентрації реагуючих речовин швидкістьреакції збільшується. К. Гульдберг та П.Bare ( І867p.) відкрили основний закон хімічної кінетики - закон діючих мас: при постійній температурі швидкість хімічної реакції прямо пропорційна добутку концентрації реагуючих речовин.
Н2 + І2 Û 2НІ, V = k[H2]×[I2],
2NO + О2 Û 2NO2, V = k[NO]2×[О2]
V = k[A]m × [B]n
для реакції типу mA + nB ® С - це гомогенні реакції
k - коефіцієнт пропорційності чи const швидкості реакції
[ А ] [ В ] - молярні концентрації речовин А та В
m та n - стехіометричні коефіцієнти.
V = kCam ∙ Свn
Фізична суть k: якщо концентрація кожної з реагуючих речовин дорівнює
1 моль/л, тоді V = k, кінетичне рівняння реакції.
В кінетичне рівняння не включають речовини, які знаходяться в твердому стані, оскільки вони реагують поверхнево, а не всім об'ємом.
С + О2 = СО2 V = k [О2]
Реакція протікає тим швидше, чим більше концентрація О2. Це гетерогенні реакції. Для них треба враховувати 3 стадії:
1) вступ реагуючих речовин до поверхні;
2) хімічна взаємодія на поверхні;
3) звільнення поверхні від продукту реакції.
В залежності від природи реакції одна із стадій може виявитися як лімітуюча. В гетерогенних процесах треба враховувати ступінь дисперсності твердого тіла (наприклад, вугільний чи мучний пил має дуже малу дисперсність, тому при підпаленні самочинно дає вибухи).
Вплив температури.
З підвищенням температури швидкість хімічної реакції зростає. Вант-Гофф встановив правило: при підвищенні температури на кожні 10°С швидкість більшості реакцій збільшується в 2 - 4 рази.
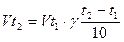
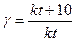
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Адресація в системі ЕП НБУ.
- Акти Конституційного Суду України в системі національного законодавства.
- Акти Конституційного суду України в системі національного законодавства.
- Акціонерна власність в економічній системі
- Алгоритми арифметичних операцій над цілими невід’ємними числами у десятковій системі числення.
- Аналіз посередників в системі розподільчої політики
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- АРХІВНІ ДОВІДНИКИ В СИСТЕМІ НДА: ФУНКЦІЇ ТА СТРУКТУРА
| <== попередня сторінка | | | наступна сторінка ==> |
| Температури замерзання | | | Хімічна рівновага. Принцип Ле – Шательє |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |