
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічна рівновага. Принцип Ле – Шательє
Необоротні реакції після завершення реакції не можуть утворювати вихідні речовини Zn + 2HNO3 ® Zn (NO3)2 + H2. Більшість відомих реакцій є оборотними.
N2 + 3H2 Û 2NH3
На початку швидкість прямої реакції (V1) велика, a V2 = 0, з часом V1 зміщується, a V2 збільшується. Коли V1 = V2 ( при t = const) наступає хімічна рівновага.
V1 = k1 [N2] [H2]3
V2 = k2 [NH3]2
При рівновазі:
V1 = V2
k1 [N2] [H2]3 = k2 [NH3]2

 - константа хімічної рівноваги
- константа хімічної рівноваги
mA + nB = pС + qD
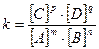 - математичний вираз закону діючих мас.
- математичний вираз закону діючих мас.
Хімічна рівновага в оборотних реакціях при Т=const встановлюється тоді, коли відношення добутку концентрацій речовин що вступили в реакцію, дорівнює концентрації речовин, утворених в результаті хімічної реакції.
Направлення зміщення рівноваги в загальному вигляді визначається
принципом Ле - Шатальє. Якщо змінити одну з умов, при яких система знаходиться в рівновазі, то рівновага буде змінюватися у напрямку реакцій, протилежних зовнішніх дій.
Вплив концентрації реагуючих речовин, температури та тиску
Збільшення концентрації реагуючих вихідних речовин зміщує рівновагу вправо, продукт реакції зміщує рівновагу вліво. Підвищення температури приводить до взаємодії частинок, які мають підвищену енергію. Ця енергія називається енергією активації. Зовнішніми джерелами активації можуть бути теплота, світлове опромінення, електрична енергія.
Залежність const швидкості ( k ) хімічної реакції від температури виражається рівнянням Арреніуса:
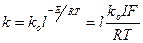
де, kо - предекспоненціальний множувач ko = zp
z - число ударів за секунду
р - стеричний фактор, який виражає ступінь найбільш вигідної орієнтації частинок при ударах
l- основа натурального логарифма
Е - енергія активації
R - універсальна газова const
Т - абсолютна температура

Тиск впливає на хімічну рівновагу тільки для тих хімічних реакцій в яких є гази, підвищення тиску буде змінювати хімічну рівновагу в напрямку менших об’ємів.
Читайте також:
- Аграрна політика як складова економічної політики держави. Сутність і принципи аграрної політики
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
- Аналогія права - вирішення справи або окремого юридичного питання на основі принципів права, загальних засад і значення законодавства.
- Антикорупційні принципи
- АРХІВНЕ ОПИСУВАННЯ: ПОНЯТТЯ, ВИДИ, ПРИНЦИПИ І МЕТОДИ
- Б/. Принципи виборчого права.
- Базові принципи обліку виробничих витрат і калькулювання собівартості продукції
- Базові принципи психології спорту.
- Банківська система: сутність, принципи побудови та функції. особливості побудови банківської системи в Україн
- Банківська система: сутність, принципи побудови та функції. Особливості побудови банківської системи в Україні.
- Банківська система: сутність, принципи побудови та функції. Особливості побудови банківської системи в Україні.
- Безперервність як провідний принцип реформування освітніх систем
| <== попередня сторінка | | | наступна сторінка ==> |
| Константа швидкості реакції в гомогенній системі та гетерогенній. | | | Типи хімічних реакцій |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |