
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Основні закони хімії
Розділ хімії, в якому розглядаються масові та об’ємні відношення між речовинами, які реагують, називається стехіометрієй.
Основу стехіометрії становлять стехіометричні закони.
Закон збереження маси (Ломоносов): в результаті хімічних перетворень сума мас речовин до реакції і сума мас речовин після реакції однакова.
З точки зору АМУ суть закону полягає в тому, що при реакціях атоми не зникають і не виникають з нічого – їх кількість залишається незмінною до та після реакції. Так як атоми мають постійну масу і їх кількість є постійною, то і маси речовин до та після реакції залишається незмінною.
Цей закон є основою при вивченні реакцій між різноманітними речовинами та розстановки коефіцієнтів в рівнянні хімічної реакції.
2Н2 + О2 → 2Н2О
4г 32г 36 г
Закон сталості складу: кожна речовина має постійний якісний і кількісний склад незалежно від способів її одержання. Речовини, що отримані різними способами, але які мають той самий якісний і кількісний склад, мають однакові хімічні властивості.
2Н2 + О2 → 2Н2О
HCl + NaOH → NaCl + H2O
CH4 + 2O2 → CO2 + 2H2O
Закон кратних відношень: якщо два елементи утворюють один з одним кілька хімічних сполук, то маси одного елемента, що приходяться на ту саму масу іншого елемента, відносяться між собою як невеликі цілі числа.
теоретично розраховані маси елементів, киї повинні вступити в реакцію
28 16 14 16 28 48 14 32 28 80 –
N2 O N O N2O3 NO2 N2O5
14 8 14 16 14---24 14 32 14 40 – розрахунок на 1 моль нітрогену
випишемо окремо числа 8:16:24:32:40
Скоротимо їх на 8: 1:2:3:4:5
Закон об'ємних відношень: об'єми взаємодіючих газоподібних речовин відносяться між собою і до об'ємів продуктів реакції, як невеликі цілі числа.
H2 + Cl2 → 2HCl
1 об. 1 об. 2 об.
V(H2): (V(Cl2) : V(HCl) = 1:1:2
N2 + 3H2 → 2NH3
1 об. 3 об. 2 об.
V(N2): (V(H2) : V(NH3) = 1:3:2
Закон Авогадро (1811 р.): у рівних об'ємах різних газів при однакових умовах міститься однакове число часток (молекул, атомів, йонів).
Висновки:
1. Моль будь-якого газу при нормальних умовах займає об'єм 22,4 л.
2. Моль будь-якого газу за нормальних умов містить 6,02 · 1023 часток (стала Авогадро NА).
H2 O2 N2 Cl2
 2 г/моль 32 г/моль 28 г/моль 71 г/моль
2 г/моль 32 г/моль 28 г/моль 71 г/моль
 22,4 л
22,4 л
6,02 · 1023 частинок
Закон еквівалентів:
2. Маси (об'єми) речовин, що реагують, пропорційні молярним масам (об'ємам) їхніх еквівалентів:
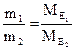
Хімічні реакції діляться на реакції, які йдуть без зміни ступеня окиснення елементів – це реакції обміну, наприклад
AgNO3 +NaCl 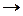 AgCl+NaNO3
AgCl+NaNO3
А також реакції, які йдуть зі зміною ступеня окиснення елементів. Це реакції сполучення, наприклад
2SO2+O2=2SO3
Реакція розкладу, наприклад
2KClO3=KCl+3O2
Реакція заміщення, наприклад
Zn+2HCl 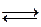 ZnCl2+H2
ZnCl2+H2
Хімічні рівняння, в яких вказано тепловий ефект реакції називаються термохімічними рівняннями.
Реакції, в результаті яких тепло виділяється, називаються екзотермічними реакціями.
2Н2+О2=2Н2О+483,2 кДж.
Реакції, в результаті яких тепло поглинається називаються ендотермічними реакціями.
N2O4=2NO2-58.1 кДж.
Тепловий ефект реакції віднесений до утворення 1 моль речовини із простих речовин, називається теплотою утворення даної речовини.
Величина теплового ефекту реакції, а відповідно і теплоти утворення речовин залежить від агрегатного стану речовин, які приймають участь в реакції. Кількість тепла,яке виділяється або поглинається в результаті реакції, залежить тільки від відносного запасу енергії продуктів і вихідних речовин.
Якщо цей відносний запас енергії виміряне при постійному тиску, то він називається ентальпією (Н). Екзотермічна реакція відповідає негативному значеню 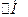 реакцією.
реакцією.
2Н2+О2=2Н2О; 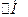 = -483,2 кДж
= -483,2 кДж
Якщо 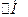 відноситься до утворення 1 моль речовини із простих речовин,, то така зміна ентальпії називається ентальпією утворення речовини. (
відноситься до утворення 1 моль речовини із простих речовин,, то така зміна ентальпії називається ентальпією утворення речовини. (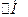 f).
f).
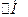 f 298 простих речовин в їх стійких станах дорівнює 0.
f 298 простих речовин в їх стійких станах дорівнює 0.
Основний закон термохімії – закон, відкритий в 1840 році російським хіміком Г. І. Гессом. Суть цього закону в тому, що зміна ентальпії залежить тільки від виду і стану вихідних речовин і продуктів реакції але не залежить від шляху переходу. Висновки із закона Гесса, застосування якого спрощує термохімічні розрахунки, показує, що 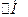 реакції =
реакції = 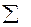
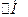 f продуктів реакції
f продуктів реакції 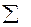
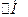 f вихідних речовин (з урахуванням стехіометрічних коефіцієнтів).
f вихідних речовин (з урахуванням стехіометрічних коефіцієнтів).
Рекомендована література
1. Михайличенко Я.И. Курс общей и неорганической химии. – М., 1965 г..
2. Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. – М.: Высшая школа, 1981 р.
3. Глінка М.Л. Загальна хімія, Київ, 2001 р.
4. Б. В. Некрасов «Учебник общей химии», Москва, 2009 г.
Читайте також:
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- II. Основні засоби
- II.3. Основні способи і прийоми досягнення адекватності
- IV. Закони ідеальних газів.
- VII. ОСНОВНІ ЕТАПИ РОЗВИТКУ УКРАЇНСЬКОЇ КУЛЬТУРИ У ХХ ст.
- А) Грошовий обіг. Закони.
- Аграрні закони України
- Адвокатура в Україні: основні завдання і функції
- Амортизація основних засобів, основні методи амортизації
- Артеріальний пульс, основні параметри
- База управлінських рішень і закони організації.
- Банківська система та її основні функції
| <== попередня сторінка | | | наступна сторінка ==> |
| Розробка застосування | | | Література |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |