
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
АДСОРБЦІЯ НА МЕЖІ РОЗЧИН – ГАЗ
Розчинені речовини в залежності від їх природи можуть концентруватися на поверхні розчину (адсорбуватися) або переходити в об'єм розчину. Це приводить до змін властивостей поверхні, наприклад поверхневого натягу.
Поверхнево-активними (ПАР) називають речовини, які зменшують поверхневий натяг розчинника.
Поверхнево–інактивними (поверхнево-неактивними)називають речовини, які збільшують поверхневий натяг або його не змінюють.
Ділення розчинених речовин на поверхнево-активні і поверхнево-неактивні умовне.
ПАР знаходять застосування більш ніж в 100 галузях і підгалузях народного господарства: нафтовій, вугільній, металургійній, хімічній промисловості, машинобудуванні, приладобудуванні, у лісовій деревообробній, целюлозно-паперовій промисловості, шкіряному виробництві, медицині, парфумерії, поліграфії, у виробництві товарів побутового призначення, у сільському господарстві, текстильній промисловості.
Близько 80% від загального об'єму вироблених ПАР споживається в промисловості мийних засобів і у виробництві тканин і виробів на основі натуральних, штучних і синтетичних волокон.
Великими споживачами ПАР є хімічна і нафтова промисловості. У текстильній промисловості ПАР застосовується для готування емульсій засобів, що замаслюють, шліхтування, у процесах підготовки вовни до прядіння, її промивання, промивання шовку, для пом'якшення - створення оптимального грифа, у підготовці у фарбуванні, друкуванні, заключній обробці.
Товарні форми ПАР являють собою порошки, водні пасти, рідини або концентровані розчини.
ПАР відносно води є багато органічних з'єднань - жирні кислоти, їх солі, спирти, карбонові кислоти та їх солі, естери аміни, кетони, білки, мила. Характерною особливістю будови молекул ПАР є їх дифільність. Дифільні (зазвичай органічні) молекули складаються з двох частин: полярної групи і неполярного вуглеводневого радикала. Наприклад, молекула оцтової кислоти має полярну групу -СООН і неполярний вуглеводний радикал -СН3. До полярних груп, крім -СООН, відносяться групи: -ОН, -NН2, -SН, -CN, -HО2, -СНО, -SО2ОН, -SO2H, -SO3Na, -SO3H.Ці групи добре гідратуються, тобто є гідрофільними. На відміну від них вуглеводневі радикали гідрофобні і сольватуються молекулами неполярних рідин.
Відносно води поверхнево-неактивними речовинами є всі неорганічні електроліти - солі, кислоти, луги. Прикладом органічних речовин, які практично не змінюють поверхневого натягу води є сахароза і лактоза.
Величина адсорбції Г на межі розчин-газ визначається не як кількість адсорбованої речовини на одиницю площі поверхні, а як надлишок речовини в поверхневому шарі, в порівнянні з кількістю речовини в такому ж по товщині шарі об'ємної фази. Між надлишком адсорбованої речовини в поверхневому шарі Г і концентрацією його в розчині С існує математична залежність, встановлена Гіббсом і відома як рівняння адсорбції Гіббса :
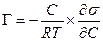 ,
,
відношення dσ/dС називається поверхневою активністю.
Поверхнева активність dσ/dС – це міра здатності речовини знижувати поверхневу енергію на даній межі поділу.
Для ПАР (dσ/dС<0), тому Г>0, для поверхнево-неактивних речовин dσ/dС>0 і Г<0, тобто адсорбція від'ємна. Якщо поверхневий натяг не змінюється при зміні концентрації розчиненої речовини, то dσ/dС і Г=0. Поверхнева активність дифільних молекул ПАР залежить від розміру вуглеводневого радикалу.
Чим довший неполярний вуглеводневий ланцюг, тим більше молекул ПАР з об'єму розчину переходить поверхню і тим більше знижується поверхневий натяг.
Залежність між довжиною вуглеводневого ланцюга і здатністю ПАР знижувати поверхневий натяг сформульовано у вигляді правила Траубе:
Збільшення довжини ланцюга молекул ПАР в даному гомологічному ряду на одну групу –СH2 викликає збільшення поверхневої активності в 3-3,5 рази.
Молекули ПАР, які складаються з полярної групи і неполярного вуглеводневого радикала, на межі системи водневий розчин—газ утворюють адсорбційний шар товщиною в одну молекулу - молекулярний шар. Будова мономолекулярного шару, тобто розташування в ньому молекул, залежить від концентрації розчину. При низьких концентраціях ПАР в розчині і відповідно в адсорбційному шарі полярна група дифільної молекули занурена в воду, а її гнучкий вуглеводневий радикал лежить на поверхні води, бо між молекулами води і радикалом існують сили притягання. При збільшенні концентрації розчину молекули ПАР спочатку з'єднуються в агрегати, в яких вуглеводневі радикали орієнтуються паралельно один одного і перпендикулярно до поверхні води, а потім вся поверхня рідини покривається мономолекулярним шаром вертикально орієнтованих молекул. При подальшому збільшенні концентрації ПАР в розчині будова адсорбційного шару, а також поверхневий натяг не змінюється.
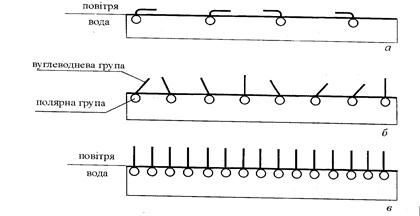 Рис.12. Розміщення молекул поверхнево-активної речовини на поверхні води при малих (а), середніх (б) і великих (в) концентраціях ПАР.
Рис.12. Розміщення молекул поверхнево-активної речовини на поверхні води при малих (а), середніх (б) і великих (в) концентраціях ПАР.
Знаючи величину адсорбції Г при утворені на поверхні мономолекулярного шару, можна розрахувати площу S0, яку займає одна молекула:
S0=1/(Г ∙ NА),
де NА – число Авогадро NА = 6,02∙1023моль-1,
(Г ∙ NА) - число молекул, адсорбованих на одиниці площі поверхні.
Площа S0, що займає одна молекула, не залежить від довжини вуглеводневого ланцюга і визначається тільки полярною групою дифільної молекули.
Читайте також:
- THERMA-thin – аналог THERMA-СHEK, не загущує буровий розчин.
- Агрегативна стійкість і коагуляція колоїдних розчинів
- Адсорбція
- Адсорбція
- АДСОРБЦІЯ , ЇЇ ВИДИ
- Адсорбція електролітів
- Адсорбція електролітів
- АДСОРБЦІЯ З БАГАТОКОМПОНЕНТНИХ РОЗЧИНІВ
- Адсорбція на межі розчин – газ.
- Адсорбція на межі тверде тіло – розчин.
- АДСОРБЦІЯ НА МЕЖІ ТВЕРДЕ ТІЛО-ГАЗ
| <== попередня сторінка | | | наступна сторінка ==> |
| АДСОРБЦІЯ , ЇЇ ВИДИ | | | АДСОРБЦІЯ НА МЕЖІ ТВЕРДЕ ТІЛО-ГАЗ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |