
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Спряження потоків у біологічних системах
Для багатьох життєво важливих процесів, що проходять у відкритих біологічних системах, характерним є явище, яке називається спряженням потоків. Розглянемо суть цього явища, використовуючи основні положення термодинаміки незворотних процесів для відкритих біологічних систем, в яких крім дисипативних процесів дифузії, теплопровідності, в'язкості відбуваються також і хімічні (біохімічні) реакції.
Спочатку зупинимося коротко на описанні хімічних реакцій, що використовується в термодинаміці незворотних процесів. Для відкритих багатокомпонентних систем термодинамічні потенціали містять, як зазначалося в розділі 7.1, доданок  де сума береться по кількості компонентів
де сума береться по кількості компонентів 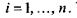 У хімічно (біохімічно) реагуючих системах виявляється корисним введення деякого внутрішнього параметру (узагальненої координати)
У хімічно (біохімічно) реагуючих системах виявляється корисним введення деякого внутрішнього параметру (узагальненої координати) 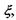 який називається степенем повноти, або числом обертів (пробігів) реакції. Зміна цього параметру є інтегральною характеристикою реакції, пов'язаної зі зміною кількості молей
який називається степенем повноти, або числом обертів (пробігів) реакції. Зміна цього параметру є інтегральною характеристикою реакції, пов'язаної зі зміною кількості молей  реагуючих компонентів наступним співвідношенням:
реагуючих компонентів наступним співвідношенням:
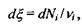 (5.13)
(5.13)
де 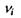 - стехіометричні коефіцієнти реакції, тобто числові коефіцієнти перед хімічними символами речовин у рівнянні реакції
- стехіометричні коефіцієнти реакції, тобто числові коефіцієнти перед хімічними символами речовин у рівнянні реакції 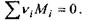 Очевидно, що зміна кількості молей всіх речовин в хімічно реагуючій системі повністю визначається зміною числа молей одного певного компоненту
Очевидно, що зміна кількості молей всіх речовин в хімічно реагуючій системі повністю визначається зміною числа молей одного певного компоненту  що й дає можливість ввести величину
що й дає можливість ввести величину 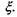 Зауважимо, що рівняння, яке позв'язує
Зауважимо, що рівняння, яке позв'язує  є рівнянням стану системи з хімічними (біохімічними) реакціями. Тоді маємо
є рівнянням стану системи з хімічними (біохімічними) реакціями. Тоді маємо
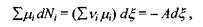 (5.14)
(5.14)
де величина 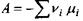 називається спорідненістю або афінністю хімічної (біохімічної) реакції. Ця величина була введена у хімічну термодинаміку де Донде і характеризує близькість системи до хімічної рівноваги. Так, для ізобарично-ізотермічної системи маємо:
називається спорідненістю або афінністю хімічної (біохімічної) реакції. Ця величина була введена у хімічну термодинаміку де Донде і характеризує близькість системи до хімічної рівноваги. Так, для ізобарично-ізотермічної системи маємо:
а) у рівновазі 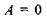 відповідно зміна вільної енергії Гіббса
відповідно зміна вільної енергії Гіббса 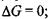
б) при 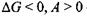 - реакція можлива;
- реакція можлива;
в) при  - реакція виявляється неможливою.
- реакція виявляється неможливою.
Хімічні (біохімічні) реакції, поряд з розглянутими раніше незворотними процесами дифузії, теплопровідності, в'язкості, також дають внесок у виробництво ентропії. Як було показано в попередньому параграфі, виробництво ентропії визначається добутком потоків 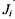 і термодинамічних сил
і термодинамічних сил 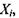 що їх викликають, тобто
що їх викликають, тобто  Для хімічно реагуючої системи вибір потоку
Для хімічно реагуючої системи вибір потоку 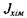 і термодинамічної сили
і термодинамічної сили 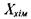 визначається такими співвідношеннями:
визначається такими співвідношеннями:

Відповідно виробництво ентропії у такій системі отримує додатковий внесок, а саме:
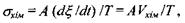 (5.15)
(5.15)
де 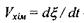 - швидкість хімічної реакції.
- швидкість хімічної реакції.
Тепер перейдемо безпосередньо до поняття спряження потоків. Нехай у досліджуваній системі відбуваються одночасно дві реакції, котрі є єдиними джерелами незворотності. Тоді виробництво ентропії у відповідності з формулою (5.15) має вигляд

і є додатною величиною в силу 2-го закону термодинаміки. Ця нерівність спостерігається не тільки в тому випадку, коли кожний з доданків є додатним, але й тоді, коли один з них (скажімо, перший) - від'ємний, а другий - додатний і більший першого за модулем, тобто

У цьому випадку прийнято називати першу реакцію спряженою, а другу - спрягаючою. Очевидно, що одна перша реакція була б неможливою в ізольованій системі, оскільки для неї спорідненість А є від'ємна величина і виробництво ентропії в результаті цієї реакції також від'ємне. Однак ця реакція стає можливою через наявність іншої реакції, для якої виробництво ентропії є величина додатна.
Саме така ситуація і називається спряженням потоків, або спряженням незворотних процесів. Точніше кажучи, спряженням потоків (процесів) називається таке співвідношення між потоками (процесами), при якому додатне виробництво ентропії від одного потоку (процесу) компенсує зменшення ентропії від другого потоку (процесу), яке було б неможливе в ізольованій системі.
Приклад 1. Фосфорилювання глюкози відбувається в результаті такої реакції:
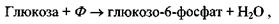
де 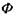 - іон фосфорної кислоти. Цей процес сам по собі виявляється неможливим, так як у результаті цієї реакції відбувається збільшення вільної енергії Гіббса на величину
- іон фосфорної кислоти. Цей процес сам по собі виявляється неможливим, так як у результаті цієї реакції відбувається збільшення вільної енергії Гіббса на величину 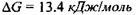 (див. кінець параграфа 5.1). Проте процес фосфорилювання стає можливим при його спряженні з іншим процесом - гідролізом АТФ:
(див. кінець параграфа 5.1). Проте процес фосфорилювання стає можливим при його спряженні з іншим процесом - гідролізом АТФ:

Під час останньої реакції вільна енергія Гіббса зменшується на величину  Перша реакція (фосфорилювання глюкози) є спряженою, друга (гідроліз АТФ) - спрягаючою. Результуюча реакція (брутто-реакція) записується у вигляді
Перша реакція (фосфорилювання глюкози) є спряженою, друга (гідроліз АТФ) - спрягаючою. Результуюча реакція (брутто-реакція) записується у вигляді
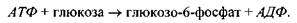
Для такої результуючої реакції зміна вільної енергії Гіббса є від'ємною величиною: 
Таким чином, спорідненість такої реакції є величиною додатною  що робить її можливою.
що робить її можливою.
Приклад 2. У ізольованій системі при наявності одного сорту частинок процес дифузії йде в напрямку від місць, де концентрація речовин більша, в місця, де вона менша. При наявності хоча б двох сортів частинок, а в загальному випадку - у багатокомпонентній системі, потік частинок будь-якого компоненту може рухатися в напрямку зростання концентрації.
Приклад 3. Своєрідне поєднання процесів, котрі розглянуто в перших двох прикладах, відбувається при активному транспорті речовини через біологічні мембрани, молекулярні механізми якого були описані в шостому розділі. В результаті активного транспорту речовина (наприклад, іони натрію та калію) переноситься в напрямку збільшення концентрації. Такий спряжений процес виявляється можливим завдяки спрягаючій реакції - реакції гідролізу АТФ.
Читайте також:
- XV. Фінансові результати від первісного визнання та реалізації сільськогосподарської продукції та додаткових біологічних активів
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- АНАЛІЗ ГРОШОВИХ ПОТОКІВ
- Аналіз руху та ефективності формування грошових потоків
- Арифметичні операції в різних системах числення
- БУДОВА І ВЛАСТИВОСТІ БІОЛОГІЧНИХ МЕМБРАН
- В системах електропостачання.
- Взаємозв’язок фінансових потоків та інфляційних процесів
- Взаємозв’язок фінансових потоків та інфляційних процесів
- Взаємозв’язок “вхід –трансформація –вихід “ на типових виробничих системах
- ВИБІР ШЛЯХІВ ПЕРЕМІЩЕННЯ ВАНТАЖОПОТОКІВ
- Види робіт, що пов'язані зі шкідливою дією біологічних чинників на організм
| <== попередня сторінка | | | наступна сторінка ==> |
| Принцип симетрії кінетичних коефіцієнтів і виробництво ентропії | | | Стаціонарний стан відкритих систем і теорема Пригожина щодо мінімуму виробництва ентропії |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |