
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електроліз.
Окисно-відновні процеси супроводжуються переходом валентних електронів від одних елементів до інших. Процес віддачі електронів називається окисненням, а процес приєднання електронів -відновленням.
Окисно-відновні реакції.
Коли елемент перебуває у вільному стані, він електронейтральний (число електронів відповідає заряду ядра), тобто знаходиться в нульовому ступені окиснення. Коли елемент віддає свої електрони, він окиснюється (переходить в окислений стан) і ступінь його окиснення збільшується. Такий елемент в реакціях називають відновником. Приєднуючи електрони, елемент відновлюється. Він зменшує ступінь свого окиснення і виступає в реакціях окисником.
В залежності від того, до складу яких вихідних речовин входять окисник та відновник, окисно-відновні реакції (ОВР) можна розділити на три основні типи:
 а) реакції міжмолекулярного окиснення-відновлення (ММОВ), коли окисник і відновник входять до складу молекул різних вихідних речовин:
а) реакції міжмолекулярного окиснення-відновлення (ММОВ), коли окисник і відновник входять до складу молекул різних вихідних речовин:
б) реакції внутрішньомолекулярного окиснення-відновлення
 (ВМОВ), коли окисник і відновник входять до складу однієї і тієї ж вихідної речовини:
(ВМОВ), коли окисник і відновник входять до складу однієї і тієї ж вихідної речовини:
в) реакції самоокиснення-самовідновлення (СС),коли окисник і відновник - атоми одного й того ж елемента входять до складу однієї і тієї ж вихідної речовини і мають однаковий ступінь окиснення:
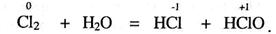 |
Як розставити коефіцієнти в окисно-відновних реакціях? Складаючи рівняння окисно-відновних реакцій слід пам'ятати, що електрони переходять від відновника до окисника, причому число електронів, відданих відновником, дорівнює числу електронів прийнятих окисником. При складанні електронного балансу та підборі коефіцієнтів в ОВР слід дотримуватись певних правил і міркувань:
 а) Написати формули вихідних речовин і продуктів реакції, знайти елементи, що змінили ступінь окиснення, вказавши окисник, відновник і тип ОВР:
а) Написати формули вихідних речовин і продуктів реакції, знайти елементи, що змінили ступінь окиснення, вказавши окисник, відновник і тип ОВР:
б) Коефіцієнти слід починати ставити в правій частині рівняння ні винятком деяких реакцій ММОВ,в яких окисник і відновник сходяться в один продукт реакції або коли окисник чи відновник потрапляє (розходиться) в різні продукти реакції. В таких випадках коефіцієнти треба починати ставити зліва;
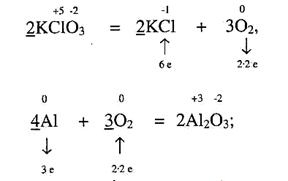 в) Число електронів, відданих відновником в розрахунку на всі пою атоми у молекулі, ставиться як коефіцієнт перед окисником, а число електронів, що приймає окисник, теж в розрахунку на молекулу ставиться як коефіцієнт перед відновником. Це – основні коефіцієнти. Якщо вони мають спільний дільник, то, відповідно, скорочуються:
в) Число електронів, відданих відновником в розрахунку на всі пою атоми у молекулі, ставиться як коефіцієнт перед окисником, а число електронів, що приймає окисник, теж в розрахунку на молекулу ставиться як коефіцієнт перед відновником. Це – основні коефіцієнти. Якщо вони мають спільний дільник, то, відповідно, скорочуються:
г) Зрівнюється число атомів окисника, відновника та інших елементів у обох частинах рівняння, після чого робиться перевірка, к правило, за киснем.
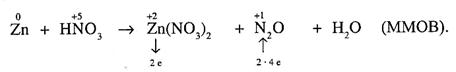 Приклад: розставити коефіцієнти в рівнянні реакції взаємодії цинку з розведеною азотною кислотою:
Приклад: розставити коефіцієнти в рівнянні реакції взаємодії цинку з розведеною азотною кислотою:
Цинк у цій реакції окиснюється від 0 до +2 (відновник), нітроген відновлюється від +5 до +1 (окисник), реакція міжмолекулярного окиснення-відновлення, коефіцієнти починаємо розставляти в правій частині рівняння. Цинк віддає 2 електрони, а нітроген в розрахунку на молекулу приймає 2∙4=8 електронів. Після скорочення перед Zn(NО3)2 ставимо коефіцієнт 4, а перед N2О лишається 1 (4 і 1 - основні коефіцієнти). Обчисливши суму атомів нітрогену в правій частині рівняння, перед НNО3 ставимо коефіцієнт 10, перед Zn – коефіцієнт 4. Оскільки зліва 10 атомів гідрогену, перед водою ставимо коефіцієнт 5 і виконуємо перевірку за оксигеном (по 30 атомів зліва і справа). Остаточно рівняння має такий вигляд:

В процесі роботи гальванічного елемента енергія окисно-відновної хімічної реакції перетворюється на електричну енергію. Але можливе і протилежне перетворення - електричної енергії на енергію хімічних речовин. Таке перетворення має місце під час пропускання постійного електричного струму через розчини або розплави електролітів. В цих випадках за рахунок електричної енергії відбуваються несамочинні окисно-відновні процеси.
Як приклад розглянемо процеси, що відбуваються під час проходження постійного електричного струму через водний розчин хлориду купруму (ІІ). Для цього в розчин СuС12 треба занурити два електроди і сполучити їх з полюсами зовнішнього джерела постійного струму. Йони Сu2+ рухаються до негативного електрода, який в даному випадку називають катодом, приймають від нього електрони і відновлюються: Сu2+ + 2ē → Сu . Йони Сl‾ рухаються до позитивного електрода (анода), віддають йому електрони і окислюються: 2С1‾→С12+ 2ē . Таким чином, хлорид купруму (II) розкладається під час електролізу на прості речовини - мідь та хлор. Слід зазначити, що в гальванічному елементі та при електролізі катод і анод мають протилежні знаки. Але в обох випадках на катоді відбувається процес відновлення, на аноді — окиснення; до катода рухаються катіони, до анода – аніони.
Оцінимо можливість самочинного перебігу реакції розкладу хлориду купруму (П) на прості речовини у водному розчині в стандартних умовах:
Сu2+ + 2Сl ‾→Сu + С12 .
У цій реакції окисником є йони Сu2+, а відновником - йони СI‾. Процесам окиснення і відновлення відповідають такі значення стандартних потенціалів:
Сu2+ + 2ē → Сu Е°ок = 0,34 В ,
2Сl‾ → С12 + 2ē E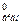 = 1,36 В.
= 1,36 В.
Різниця потенціалів окисника і відновника (0,34 – 1,36 = –1,02 В) – від'єм-на, тобто процес самочинно не відбувається.
Таким чином, електроліз – це несамочинний окисно-відновний процес, що відбувається під час пропускання постійного електричного струму через розчин або розплав електроліту. Електроліз широко використовується в металургії для добування і рафінування металів, нанесення на поверхню металів захисних металічних покриттів (наприклад, хромування та нікелювання заліза), синтезу багатьох неорганічних та органічних речовин.
Різниця потенціалів, яку необхідно створити, щоб відбувався процес електролізу, повинна бути більшою від певної величини, яку називають потенціалом розкладу.Потенціал розкладу дорівнює ЕРС гальванічного елемента, складеного з двох електродів, до яких входять вихідні речовини і продукти електролізу. У розглянутому прикладі він становить 1,02 В.
Вивчаючи залежність маси речовин, що виділяються на електродах під час пропускання електричного струму,від кількості пропущеної електрики, М.Фарадей (1791-1867) сформулював два закони електролізу:
- маса речовини, що виділяється під час електролізу, пропорційна кількості пропущеного електричного струму;
- якщо крізь розчини або розплави різних електролітів пропустити однакову кількість електричного струму, то маси речовин, що виділяються на електродах, пропорційні їх еквівалентним масам.
Обидва закони тісно пов'язані між собою. їх можна пояснити з погляду атомно-молекулярної теорії. Справді, якщо для виділення на електроді одного атома потрібно п електронів (Аn+ + пē →А або Аn– → А + nē), то зі збільшенням кількості електронів пропорційно збільшується кількість атомів, що виділяються на електродах (перший закон Фарадея). Для виділення одного моля (тобто 6,022∙1023) атомів потрібно відповідно 6,022∙1023n електронів. Тоді 6,022∙1023 електронам, пропущеним через розчин або розплав електроліту, відповідає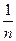 частина моля атомів елемента. У наведених вище реакціях окиснення та відновлення число прийнятих або відданих атомом електронів збігається з його формальною валентністю. Нагадаємо, що частина атома, яка відповідає одиниці його валентності, називається еквівалентом, тобто
частина моля атомів елемента. У наведених вище реакціях окиснення та відновлення число прийнятих або відданих атомом електронів збігається з його формальною валентністю. Нагадаємо, що частина атома, яка відповідає одиниці його валентності, називається еквівалентом, тобто 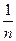 частина моля атомів – це 1 моль еквівалентів. Тому для виділення 1 моль еквівалентів речовини треба пропустити через розчин або розплав електроліту 1 моль електронів. Заряд 1 моль електронів дорівнює добутку заряду електрона на число електронів, тобто 1,602 ∙10-19 ∙ 6,022∙1023 = 96487 Кл. Ця величина, яку позначають латинською літерою F, була експериментально визначена Фарадеєм і на його честь названа сталою Фарадея. Якщо через розчин або розплав електроліту пропускати іншу кількість струму (Q), то відповідно будуть змінюватись і маси речовин, що утворюються на електродах. Але у всіх випадках вони будуть пропорційні еквівалентним масам елементів, що відповідає наведеному вище формулюванню другого закону Фарадея. Наведені співвідношення дозволяють розрахувати маси речовин, що утворюються на електродах внаслідок пропускання певної кількості струму (Q) Дійсно, число молів електронів (nел.), пропущених під час електролізу, дорівнює відношенню Q/F, а число молів еквівалентів речовини (nреч) - відношенню її маси т до молярної маси еквівалентів. Оскільки nел = nреч, то:
частина моля атомів – це 1 моль еквівалентів. Тому для виділення 1 моль еквівалентів речовини треба пропустити через розчин або розплав електроліту 1 моль електронів. Заряд 1 моль електронів дорівнює добутку заряду електрона на число електронів, тобто 1,602 ∙10-19 ∙ 6,022∙1023 = 96487 Кл. Ця величина, яку позначають латинською літерою F, була експериментально визначена Фарадеєм і на його честь названа сталою Фарадея. Якщо через розчин або розплав електроліту пропускати іншу кількість струму (Q), то відповідно будуть змінюватись і маси речовин, що утворюються на електродах. Але у всіх випадках вони будуть пропорційні еквівалентним масам елементів, що відповідає наведеному вище формулюванню другого закону Фарадея. Наведені співвідношення дозволяють розрахувати маси речовин, що утворюються на електродах внаслідок пропускання певної кількості струму (Q) Дійсно, число молів електронів (nел.), пропущених під час електролізу, дорівнює відношенню Q/F, а число молів еквівалентів речовини (nреч) - відношенню її маси т до молярної маси еквівалентів. Оскільки nел = nреч, то:
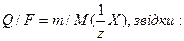
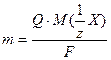
У розчинах і розплавах електролітів може знаходитись кілька різних катіонів та аніонів. Ці йони, а також молекули розчинника можуть брати участь в окисно-відновних процесах на електродах. Розглянемо послідовність процесів, що відбуваються на електродах.
Коли в розчині присутні кілька різновидів катіонів, на катоді насамперед відновлюються ті з них, у яких більше виражені окисні властивості, а це відповідає більш високому значенню окисно-відновного потенціалу. Наприклад, з розчину, в якому містяться йони Сu2+ та Ni2+, першою на катоді виділятиметься мідь, оскільки стандартний потенціал процесу Сu2+ + 2ē→ Сu (+0,34 В) вищий, ніж потенціал відновлення нікелю Ni2+ + 2→Ni (–0,25 В).
На катоді також може відновлюватись гідроген води: 2Н2О + 2ē→ 2ОН ‾ + Н2 . Потенціал відновлення водню на катоді можна розраху-вати за формулою Нернста. Він залежить від кислотності середовища: згідно з рівнянням за значень рН 0; 7 і 14 він дорівнює відповідно 0; –0,41 і –0,83 В. Під час електролізу водних розчинів у нейтральному середовищі (рН = 7) катіони металів, відновленню яких відповідає потенціал більш позитивний, ніж –0,41 В (Сu2+, Аg+, Аu3+ та ін.), виділяються на катоді легше, ніж гідроген води. Навпаки, якщо відновленню катіонів відповідають великі негативні значення електродних потенціалів (катіони лужних та лужноземельних металів, магнію, алюмінію), на катоді з водних розчинів відповідні метали не виділяються, оскільки набагато легше відбувається відновлення гідрогену води. Такі метали можна добути шляхом електролізу розплавів сполук (найчастіше солей) цих металів.
Складнішою є ситуація, коли відновленню катіонів металу відповідають невеликі негативні значення електродних потенціалів (-1,1...0 В). Різниця цих потенціалів і потенціалу відновлення гідрогену води - невелика. Оскільки під час електролізу потенціали електродів зазвичай точно не контролюються, на катоді практично одночасно виділяються відповідні метали і водень з води. Крім того, треба зазначити, що умови, в тому числі й концентрації речовин, під час електролізу можуть значно відрізнятись від стандартних, що також впливає на значення потенціалів.
Але ще більш важливим є те, що значення стандартних потенціалів відповідають положенню рівноваг на електродах, тобто умовам, коли сила струму наближається до нуля. Зі збільшенням густини струму (тобто відношення сили струму до площі електрода) рівноваги на електродах суттєво зміщуються, відбувається поляризація електродів, внаслідок чого потенціали виділення речовин на електродах можуть значно відрізнятись від рівноважних. Різниця рівноважного значення потенціалу і того його значення, за якого речовина виділяється на електроді за певної густини струму, називається перенапругою.Більш детально механізм поляризації електродів буде розглянуто в наступному розділі
Величина перенапруги залежить від природи частинок, що розряджаються, матеріалу електрода та умов електролізу. Перенапруга зміщує електродні потенціали процесів на катоді до більш негативних значень. Найбільш суттєво перенапруга впливає на процеси виділення газів.
Так, перенапруга виділення газоподібного водню на ртуті може сягати –2 В. Це дає змогу осаджувати на катоді з водних розчинів відповідних електролітів метали (хром, цинк, манган та ін.), стандартні окисно-відновні потенціали яких більш негативні, ніж рівноважний потенціал відновлення гідрогену.
На аноді аніони окиснюються в послідовності, що визначається їх відновними властивостями. Спочатку окиснюється той аніон, якому відповідає більш негативне значення потенціалу (сильніший відновник). Наприклад, процесам окиснення безкисневих йонів: 2Вг‾ → Вг2 + 2ē ; 2І‾→ І2 + 2ē ; S2‾→ S + 2ē відповідають стандартні потенціали відповідно +1,06В, +0,53 В і –0,48 В. Отже, окиснення аніонів у ряду Вг‾, I ‾ S2‾ полегшується, і всі вони окислюються на аноді легше, ніж оксиген води, стандартний потенціал процесу виділення якого у кислому середовищі: 2Н2О→ О2 + 4ē + 4Н+ становить +1,23 В.
Стандартний потенціал процесу окиснення хлорид-йонів на аноді: 2СI ‾→ С12 +2ē складає +1,36 В, що є досить близьким до потенціалу окиснення води. Тому хлор і кисень в процесі електролізу водних розчинів хлоридів можуть виділятися на аноді одночасно. Але зі збільшенням густини струму перенапруга для процесу виділення кисню зростає набагато швидше. Тому за великої густини струму на аноді виділяється переважно хлор. З іншого боку, оксиген води на аноді окиснюється легше, ніж оксигенвмісні аніони (SО , NO
, NO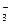 , СО
, СО та ін.), в яких центральний атом має найвищий ступінь окиснення. Найбільш високе значення потенціалу (+2,86 В) відповідає процесу окиснення йона F‾. Таким чином, оксигенвмісні аніони та фторид-йон під час електролізу водних розчинів на аноді не окиснюються, відновником є молекули води.
та ін.), в яких центральний атом має найвищий ступінь окиснення. Найбільш високе значення потенціалу (+2,86 В) відповідає процесу окиснення йона F‾. Таким чином, оксигенвмісні аніони та фторид-йон під час електролізу водних розчинів на аноді не окиснюються, відновником є молекули води.
Досі ми розглядали окисно-відновні процеси, що відбуваються під час електролізу на індиферентних (інертних) електродах – графіті, платині, деяких платинових металах, золоті, карбіді силіцію та ін. Але в процесах електролізу застосовують також аноди і з неблагородних металів. Такі метали можуть окиснюватись легше, ніж молекули води чи аніони, що містяться в розчині. Якщо, наприклад, електроліз хлориду міді вести з мідними електродами, то на аноді з двох можливих процесів - виділення хлору: 2Сl ‾ → С12 + 2ē (стандартний потенціал +1,36 В) та окиснення міді: Сu → Сu2+ + 2ē (стандартниий потенціал + 0,34 В) окиснюється мідь анода, яка переходить у розчин у вигляді йонів Сu2+, оскільки відновні властивості міді вищі. Такий електрод називається розчинним. На катоді, як і у випадку інертного електрода, відбувається відновлення міді. Отже, в процесі електролізу СuС12 з мідним анодом мідь переходить фактично з анода на катод. Такі процеси широко використовуються для очищення (рафінування) малоактивних металів, нанесення покриттів на метали тощо.
Більшість металів (окрім зазначених вище – благородних) окиснюються на аноді, і виготовлені з них аноди є розчинними. Але в деяких випадках метали пасивуються за рахунок утворення на їх поверхні захисних плівок нерозчинних сполук (наприклад, хром, титан, нікель і залізо в лужному середовищі, нержавіючі сталі) і ці аноди не розчиняються.
Читайте також:
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 4.2. Хімічні реакції | | | Швидкість хімічних реакцій |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |