
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тема 4.2. Хімічні реакції
Лекція № 12
1. Реакції йонного обміну.
2. Окисно-відновні реакції.
3. Електроліз.
1.Реакції йонного обміну.
Реакції між йонами у розчинах електролітів (так звані йошюобмііші реакції) відбуваються лише у напрямі зв'язування йонів з утворенням слабких електролітів:важкорозчинних або летких сполук, слабких кислот чи комплексних йонів. Прикладом суміші, коли реакція йонного обміну не відбувається, може бути суміш хлориду натрію NaCl і нітрату калію KNO3:
 |
Якщо до розчину нітрату барію Ba(NO3)2 добавити розчин добре розчинних сполук, що містять сульфат-йони (наприклад, Na2SO4, K2SO4, FeSO4, H2SO4 тощо), то випадає білий осад сульфату барію. Отже, реакцію йонного обміну в цих випадках можна записати рівняннями як у молекулярній
 |
так і в йонно-молекулярній формах:
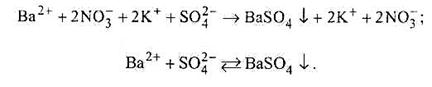 |
Отже, якщо записати добре розчинні сполуки — сильні електроліти для всіх трьох рівнянь у вигляді йонів, а слабкий електроліт BaSO4 — у молекулярній формі і скоротити однакові йони в лівій і правій частинах цих рівнянь, то побачимо, що фактично реакція відбувається між йонами
Ва2+ і SO у результаті їх зв'язування у важкорозчинну сполуку BaSO4.
у результаті їх зв'язування у важкорозчинну сполуку BaSO4.
Такі скорочені рівняння називають йонно-молекулярними.
Розглянемо найважливіші випадки йоннообміиних реакцій.
Реакції з утворенням летких речовин:
 |
Реакції утворення слабких кислот і основ:
 |
Реакції нейтралізації (взаємодія кислоти з основою):
· сильної кислоти з сильною основою;
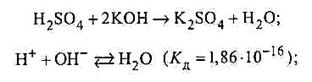 |
· слабкої кислоти з сильною основою;
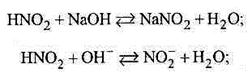 |
· слабкої основи з сильною кислотою;
 |
Реакції утворення важкорозчинних основ і амфотерних гідроксидів:
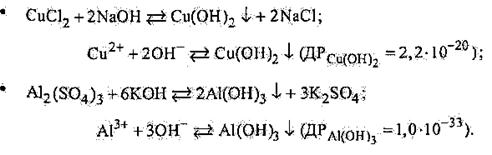 |
Реакції утворення комплексних йонів:
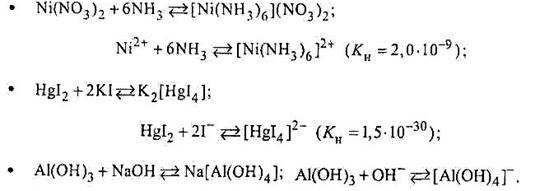 |
Отже, утворення в розчинах комплексних йонів як слабких електролітів (катіонних чи аніонних) зумовлює зміщення йонної рівноваги вправо, тобто реакції між електролітами відбуваються практично до кінця. Причому, чим стійкішим є комплексний йон (тобто чим слабкішим електролітом він є), тим повнішою буде взаємодія між йонами електролітів, що утворюють цей комплекс.
Гідроліз солей як окремий випадок реакцій йонного обміну у водних розчинах електролітів. Водні розчини багатьох нейтральних (середніх) солей не є нейтральними, що свідчить про взаємодію їхніх йонів (катіонів чи аніонів) з молекулами води. Зауважимо, що причина такої взаємодії криється у можливості утворення під час хімічної реакції слабких електролітів (зокрема, слабких кислот чи основ або ще слабкіших кислотних чи основних йонів) згідно з основною енергетичною концепцією хімічних реакцій: вони здійснюються мимовільно у напрямі зниження вільної енергії системи, тобто коли ΔG < 0.
Реакції гідролізу — йонообмінного типу взаємодії відповідних за своїм походженням йонів (катіонів чи аніонів або тих та інших одночасно), розчинених у воді солей з полярними молекулами води. Ці взаємодії призводять до розкладання молекул води і до утворення відповідних слабких електролітів: слабких кислот або гідро-аніонів кислотних солей; слабких основ чи гідроксо-катіонів основних солей; слабких кислот і слабких основ одночасно. Слід зазначити, що всі реакції (іонного обміну характеризуються одним критерієм — зменшенням значення зміни енергії Гіббса ΔG (ΔG<0), тобто вони здійснюються тільки тоді, коли можливе зв'язування йонів у молекули слабких електролітів. Це реакції нейтралізації (кислотні + основні сполуки), гідролізу, утворення осадів та летких сполук.
За походженням і, отже, за здатністю розкладати молекули води йони солей класифікують так:
 • катіони (загальна формула Меz+ (z = 2, 3, іноді 1 і 4), що походять від слабких основ, утворюваних металами і металоїдами ділянки 2 площини ПС, наприклад Cu2+, Fe2+ , Fe3+, Zn2+, Cd2+,Al3+, Sn2+ тощо. Реакції таких катіонів Mez+ з водою називають гідролізом за катіоном; їх можна записати таким рівнянням:
• катіони (загальна формула Меz+ (z = 2, 3, іноді 1 і 4), що походять від слабких основ, утворюваних металами і металоїдами ділянки 2 площини ПС, наприклад Cu2+, Fe2+ , Fe3+, Zn2+, Cd2+,Al3+, Sn2+ тощо. Реакції таких катіонів Mez+ з водою називають гідролізом за катіоном; їх можна записати таким рівнянням:
 • аніони загальної формули Аz–, що походять від слабких кислот, утворюваних як металами і металоїдами ділянки 2 площини ПС за умови значень їх z = 4, 5, 6, 7 наприклад: МnО
• аніони загальної формули Аz–, що походять від слабких кислот, утворюваних як металами і металоїдами ділянки 2 площини ПС за умови значень їх z = 4, 5, 6, 7 наприклад: МnО , МnО
, МnО , Сr2O
, Сr2O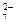 , СrО
, СrО , VO
, VO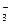 тощо, так і неметалами ділянки 3 площини ПС за умови значень їх z = +1, +3, +4, іноді -1, -2, наприклад: оксигеновмісні типу NO
тощо, так і неметалами ділянки 3 площини ПС за умови значень їх z = +1, +3, +4, іноді -1, -2, наприклад: оксигеновмісні типу NO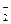 , СО
, СО , SO
, SO тощо чи прості типу F–, S2– тощо. Реакції таких аніонів Az– з водою називають гідролізом за аніоном; їх можна записати таким загальним рівнянням:
тощо чи прості типу F–, S2– тощо. Реакції таких аніонів Az– з водою називають гідролізом за аніоном; їх можна записати таким загальним рівнянням:
Отже, за природою своїх йонів у структурі молекул солі класифікують так:
• солі, побудовані з катіонів слабких основ і аніонів сильних кислот, наприклад ZnSO4, CuCl2, Fe(NO3)2, CrBr3, A12(SO4)3 тощо. Такі солі, як уже зазначалося, гідролізують за катіоном, причому ці реакції є оборотними;
• солі, побудовані з катіонів сильних основ і аніонів слабких кислот, наприклад NaF, K2S, Na2CO3, Li2SO3 тощо. Такі солі гідролізують за аніоном, причому ці реакції є оборотними;
• солі, побудовані з катіонів слабких основ і аніонів слабких кислот, гідролізують як за катіоном, так і за аніоном, причому ці реакції є практично необоротними. Більшість солей цього типу є важкорозчинними у воді, наприклад сульфіди, карбонати, сульфіди металів і металоїдів ділянки 2 площини ПС. Очевидно, що передумовою ефективного гідролізу солей є їх розчинність у воді. Отже, число солей цього типу, здатних до гідролізу, є досить обмеженим, наприклад NH4NO2, A1F-, тощо.
Розглянемо типові випадки гідролізу солей:
а) гідроліз солей, утворених катіонами слабкої основи й аніонами сильної кислоти.
Більшість таких солей утворені багатокислотними слабкими основами (наприклад, CuSO4 —від Сu(ОН)2 і від H2SO4):
 |
 Скорочуючи всі йони, які не змінювали своєї структури, тобто не брали участі в реакції, дістанемо скорочене йонно-молекулярне рівняння гідролізу:
Скорочуючи всі йони, які не змінювали своєї структури, тобто не брали участі в реакції, дістанемо скорочене йонно-молекулярне рівняння гідролізу:
 |
Утворювані при цьому гідроксокатіони (катіони основних солей) є найслабкішими електролітами:
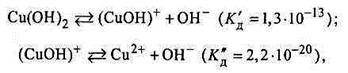 |
що видно із рівняння констант дисоціації двох можливих продуктів реакції гідролізу К <<К
<<К . Саме тому багатозарядні катіони, похідні від слабких багатокислотних основ Me(OH)z, де z =+2,+3, гідролізуються переважно за першим ступенем.
. Саме тому багатозарядні катіони, похідні від слабких багатокислотних основ Me(OH)z, де z =+2,+3, гідролізуються переважно за першим ступенем.
Рівняння гідролізу відображує, як можна керувати оборотним процесом: 1) щоб запобігти гідролізу (пригальмувати його, змістивши рівновагу вліво), до розчину слід добавляти відповідну кислоту (H2SO4); 2) щоб, навпаки, прискорити гідроліз, слід або добавляти у розчин йони ОН– (NaOH або солі, які в результаті гідролізу утворюють йони ОН–), або розбавляти розчин (тобто підвищувати концентрацію такого реагенту, як вода), що, згідно із законом дії мас, прискорить гідроліз.
б) гідроліз солей, утворених сильною основою і слабкою кислотою:
 |
або
Солі багато основних кислот можуть гідролізу вати ступінчасто:
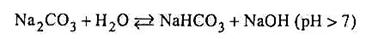 |
Або за йонно-молекулярним рівнянням
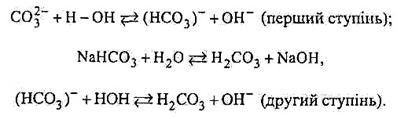 |
або
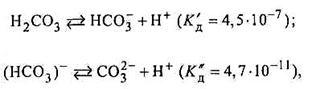 Однак гідроліз за другим ступенем майже не здійснюється, оскільки вже на першому ступені утворюється більш слабка кислота НСО3 порівняно з тією, яка утворюється за другим ступенем Н2СО
Однак гідроліз за другим ступенем майже не здійснюється, оскільки вже на першому ступені утворюється більш слабка кислота НСО3 порівняно з тією, яка утворюється за другим ступенем Н2СО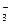 , що випливає з порівняння сили цих кислот як електролітів:
, що випливає з порівняння сили цих кислот як електролітів:
К <<К
<<К . Отже, перший ступінь гідролізу є найвигіднішим і завершеним.
. Отже, перший ступінь гідролізу є найвигіднішим і завершеним.
в) гідроліз солей, утворених слабкими основами і слабкими кислотами.
Такі реакції є майже необоротними, оскільки під час їх утворюються два слабких електроліти (слабкодисоційовані або важкорозчинні), наприклад:
 |
Кількісно гідроліз характеризують, як і процеси дисоціації, двома величинами:
 • ступенем гідролізу h, який є величиною, аналогічною ступеню дисоціації α:
• ступенем гідролізу h, який є величиною, аналогічною ступеню дисоціації α:
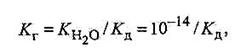 • константою гідролізу Кг як оборотного процесу, в якому рано чи пізно настає рівновага:
• константою гідролізу Кг як оборотного процесу, в якому рано чи пізно настає рівновага:
 де KR — константа дисоціації слабкого електроліту, який утворюється в реакціях перших двох типів гідролізу, тобто КД слабких основ чи КД слабких кислот. Для реакцій третього типу константа КГ матиме такий вигляд:
де KR — константа дисоціації слабкого електроліту, який утворюється в реакціях перших двох типів гідролізу, тобто КД слабких основ чи КД слабких кислот. Для реакцій третього типу константа КГ матиме такий вигляд:
де Кд.осн і Кд.кисл — відповідно константи дисоціації утворюваних у реакціях цього типу слабких основи і кислоти (константи дисоціації слабких електролітів є величинами довідковими, визначеними експериментально).
Аналіз рівнянь (3.35—3.37) для розрахунків значень h і КГ дає змогу зробити ряд важливих висновків:
Ø ступінь гідролізу h тим більший, чим меншою є концентрація розчину
солі, тобто розбавляння розчину солі сприяє гідролізу;
Ø швидкість гідролізу зростає з підвищенням температури, оскільки при
цьому зростає концентрація йонів Н+ та ОН– (зростає значення
КН О);
О);
Ø чим слабкішим є електроліт, що утворюється під час гідролізу, тобто чим меншим буде значення його КД, тим повніше гідролізуватиме сіль.
 Розрахунок концентрації йонів Н+ чи ОН–, утворюваних у перебігу гідролізу, здійснюють за формулою, аналогічною формулі для розрахунку будь-яких йонів електролітів:
Розрахунок концентрації йонів Н+ чи ОН–, утворюваних у перебігу гідролізу, здійснюють за формулою, аналогічною формулі для розрахунку будь-яких йонів електролітів:
аналогічно
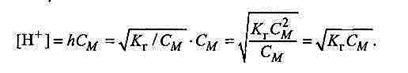 Якщо значення h невідоме, можна скористатись іншою формулою, де h замінено на Кг:
Якщо значення h невідоме, можна скористатись іншою формулою, де h замінено на Кг:
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- Біогенні аміни та реакції декарбоксилювання
- Біохімічні зміни в організмі при розтренуванні і перетренуванні
- Біохімічні основи розвитку витривалості
- Біохімічні основи розвитку силових і швидкісних якостей
- Біохімічні чинники виникнення втоми при виконанні короткочасних вправ максимальної і субмаксимальної потужності
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Види опор та їх реакції
| <== попередня сторінка | | | наступна сторінка ==> |
| VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки | | | Електроліз. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |