
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
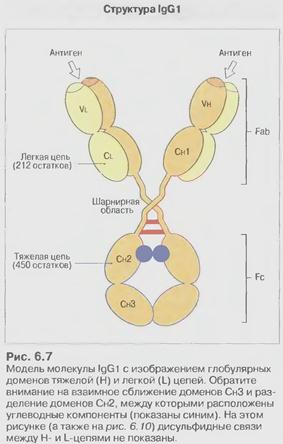
Протеолітична фрагментація імуноглобулінів.
В 50-60 р.р. ХХ ст. співробітниками лабораторій Едельмана і Портера було проведено ряд блискучих досліджень, що дали можливість свівставити структуру і функції молекул імуноглобулінів. Шляхом протеолізу можна отримати фрагменти імуноглобулінів, частина з яких зберігає здатність зв'язуватися з антигеном (Рис. ). Найбільш чутливою до протеолізу є шарнірна ділянка (регіон завіс) завдяки наявності великої кількості залишків цистеїну та проліну, що, як зазначено, забезпечують гнучкість поліпептидних ланцюгів і доступність до дії протеолітичних ферментів. Отже зміна кута між двома "ручками", що містять центри зв'язування антигену, відбувається завдяки гнучкості шарнірної ділянки молекула імуноглобуліну і сприяє кращому зв’язуванню з молекулою АГ.
Папаїн розщеплює молекулу імуноглобуліну вище шарнірної ділянки на 2Fab (Fragment antigen-binding) + Fc (Fragment cristallizable, constant) фрагменти. Fаb (по 50 кДа) зберігають властивість зв'язуватися з антигеном, оскільки містять варіабільні домени важкого та легкого ланцюгів, і є моновалентними. Fc (50 кДа) не зв'язує антиген і несе властивості, характерні для даного класу імуноглобулінів. За допомогою плазміну Fab фрагмент може бути далі розщеплений на Fv і Fd фрагменти, по 25 кДа кожний.
Пепсин розщеплює молекулу імуноглобуліну нижче шарнірної ділянки, в результаті чого утворюється двохвалентний F(ab’)2 і рFс’ фрагменти із М.М. 100 і 50 кДа, відповідно. Шляхом відновлення дисульфідних зв'язків (наприклад, за допомогою 2-меркаптоетанолу) молекулу імуноглобуліну можна розібрати спочатку на дві половинки по 75 кДа, а потім - на важкі та легкі ланцюги. Половинки повністю, а важкі ланцюги частково, зберігають здатність зв'язуватись з антигеном. (Рис.8.1; 8.2).
Рис.8.1. Протеолітична фрагментація імуноглобулінів.
 |
Рис.8.2. Протеолітична фрагментація імуноглобулінів.
 |
Деякі класи імуноглобулінів утворюють олігомерні форми. Так, ІgА утворюють димери, а ІgМ - пентамери. Пентамер утворюється за рахунок дисульфідних зв'язків між окремими молекулами ІgМ, крім того додається J-ланцюг (12 кДа), який циклізує весь олігомер у вигляді зірки. IgG, ІgD, ІgЕ зустрічаються тільки у вигляді мономерів (150 кДа) , а пентамеру ІgМ- 890-900 кДа.
Рис. 9. Мономерна і полімерні форми імуноглобулінів.
 |
Імуноглобуліни теж можна розглядати як антигени. На них відрізняють чотири типи антигенних детермінант: видові, алотипічні, ізотипічні та ідіотипічні.
Видові-характерні для імуноглобулінів всіх особин певного виду. Вони визначаються будовою важкого і легкого ланцюгів. За цими детермінантами можна визначити видову приналежність антитіл.
Алотипічні детермінанти обумовлені існуванням алельних форм (алельних генів одного локусу) імуноглобулінів і притаманні генетично різним особинам одного виду, що дає можливість їх розрізняти. У білковій структурі вони визначаються як заміни 2-3 амінокислотних залишків і розташовані на легкому і важкому ланцюгу імуноглобулінів.
Ізотипічні антигенні детермінанти локалізовані на Fс фрагментах важких ланцюгів і фактично є характеристиками 5 ізотипів (класів) і підкласів важких ланцюгів.
Ідіотипічні детермінанти відображають особливості будови антигензв'язуючого центру молекули імуноглобуліна і позв'язані з V-доменами легкого і важкого ланцюга, а саме з Fаb -фрагментами антитіл. Фактично, ідіотип визначає специфічність антитіла, він є індивідуальним для кожної молекули і до його складу входять амінокислотні залишки гіперваріабільних ділянок (CDR).
Ізо-, ало- та ідіотип-специфічні антитіла можна отримати штучно і використовувати для ідентифікації відповідних детермінант на молекулі імуноглобуліну.
Молекулу імуноглобуліну побудовано таким чином, що різні її ділянки відповідають за різні функції. Так, функцією Fаb-фрагменту є утворення центру, що зв'язує антиген. Біологічний ефект зв'язування антигену, тобто наслідок його імунного розпізнання, залежить від природи Fс-фрагменту. Це можуть бути зв'язування з Fс-рецепторами, які існують на поверхні багатьох клітин, фіксація комплементу та деякі інші, так звані ефекторні функції. Різні класи імуноглобулінів мають різні структури Fс- фрагментів і, відповідно, можуть виконувати різні функції.
 Отже, аналізуючи структуру і функції Іg треба відрізняти 2 поняття- гетерогенність і варіабельність. Гетерогенністьвизначає властивості Іg, що зумовлені константною частиною молекули, що вирізрізняє роботу різних класів цих молекул. Варіабельність – це індивідуальна характеристика Іg, що належать до одного класу або підкласу. Виявляється у специфічній антигензвязуючій активності і характеризується варіабельними доменами молекул антитіл.
Отже, аналізуючи структуру і функції Іg треба відрізняти 2 поняття- гетерогенність і варіабельність. Гетерогенністьвизначає властивості Іg, що зумовлені константною частиною молекули, що вирізрізняє роботу різних класів цих молекул. Варіабельність – це індивідуальна характеристика Іg, що належать до одного класу або підкласу. Виявляється у специфічній антигензвязуючій активності і характеризується варіабельними доменами молекул антитіл.
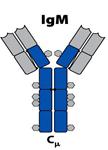 Коротка характеристика різних класів
Коротка характеристика різних класів
імуноглобулінів
ІgМ( 5-10% сироваткових Іg )
Антитіла цього класу синтезуються на початковій стадії імунної відповіді і першими з'являються в онтогенезі. На мембрані В клітин ІgМ знаходиться у вигляді мономеру із додатковим гідрофобним доменом. В цьому імуноглобуліні також міститься додатковий Сн4 домен та відсутня шарнірна ділянка, роль якої виконує другий константний домен (Сн2-домен). ІgМ містять вуглеводні залишки в доменах Сн1, Сн2, Сн3 і хвостові ділянки на С-кінці, що нараховують до 18 амінокислотних залишків.
Завдяки наявності J-joint (єднального) - ланцюга, що є поліпептидом
(137 а.з., 12 кДа) та з'єднується дисульфідними зв’язками з хвостовими ділянками ІgМ, утворюється досить жорстка пентамерна структура цього імуноглобуліну. Після активації В лімфоцити спочатку секретують пентамерний ІgМ, а потім переключаються на ІgG або інші класи імуноглобулінів. Таким чином ІgМ є першим бар'єром на шляху інфекції. Він має невисоку специфічність (спорідненість) до антигену, але завдяки своїй пентамерній формі може одночасно зв'язати п'ять молекул антигену, що в сумі дає високу авідність зв'язування.
Вільний, не зв’язаний з антигеном пентамерний ІgМ, може мати форму зірки (сніжинки), в той час як зв’язаний з антигеном, що має лінійно повторювані епітопи, форму краба. Ця форма утворюється в основному після закріплення на поверхні чужерідної клітини, що сприяє відкриванню на Сн3-домені сайтів зв’язування з білками системи комплементу, запускаючи роботу останнього по класичному шляху.
Також завдяки олігомерності ІgМ легко викликає аглютинацію(злипання) мікробіальних клітин, що сприяє їх знищенню макрофагами. Так звані "нормальні" антитіла, присутні в крові здорових індивідів, теж є здебільшого ІgМ. Наявність у сироватці високої концентрації мономерних форм ІgМ свідчить про можливість таким захворювань як ревматоїдний артрит і т.д.
Еволюційно цей клас з'явився раніше, ніж інші класи імуноглобулінів. Але недоліком пентамерних комплексів є їх низька мобільність (900 кДа). Тому ссавці "перейшли" на ІgGдля зв’язування чужорідних агентів у внутрішньому середовищі, а ІgА-в слизових.
 | |||||
 | |||||
 |

 ІgG (70-80%сироваткових Іg)
ІgG (70-80%сироваткових Іg)
Це головний клас сироваткових антитіл при вторинній імунній відповіді, є основними молекулами гуморального імунітету. При первинній імунній відповіді на 10 добу заміняють ІgМ, які утворилися першими. Маючи найменшу з усіх Іgмолекулярну масу- 150 кДа, можуть долати всі бар’єри тобто є "вездесущими".
Проходять крізь плаценту, тому у перші тижні життя ІgG матері є головним засобом захисту новонародженого від інфекцій. Містяться також у молозиві. Клітини плаценти, що "торкаються" материнської крові, містять специфічні Fс-рецептори, які зв’язують молекули ІgG, що і забезпечує їх перехід в кровоносну систему плоду. Антитіла спочатку поглинаються шляхом ендоцитозу за участі рецепторів, потім транспортуються в пухирцях через клітини і виводяться шляхом екзоцитозу у кров плоду (шлях трансцитозу). Інші антитіла не зв’язуються з цими рецепторами, тому і не можуть проходити крізь плаценту.
ІgGмають велике значення для опсонізації бактеріальних токсинів і мікроорганізмів. Нагадаю, опсонізація — утворення імунних комплексів, що сприяє знищенню антигену неімунними клітинами. Здійснюється за рахунок зв'язування комплексу: 1) з Fс-рецепторами на макрофагах i натуральних кілерах; 2) з компонентами комплементу. Зв'язування антигену призводить до зміни конформації Fс фрагменту, що значно збільшує здатність до 1) і 2) порівняно з вільними антитілами.
Всі підкласи ІgG мають велику шарнірну ділянку, а у ІgG3 вона є дуже видовженою (62 а.к залишки) і містить понад 10 дисульфідних зв’язків.
Підкласи ІgG відрізняються за своїми властивостями: здатністю до спонтанної агрегації, зв'язуванню комплементу. Їх біосинтез регулюється різними механізмами за участі різних типів Т клітин. Інколи присутність певного підкласу ІgG має критичне значення. У людини- ІgG1- 65%, ІgG2-23%, ІgG3-8% і ІgG4- 4%.
 З усіх імуноглобулінів, присутніх в сироватці крові, концентрація ІgG є найбільшою: у неімунізованої тварини – в середньому 10 мг/мл. Для порівняння, концентрація ІgМ у сироватці складає 1,5 мг/мл. Препарати людських ІgG призначаються при імунодефіцитах та при важких вірусних захворюваннях.
З усіх імуноглобулінів, присутніх в сироватці крові, концентрація ІgG є найбільшою: у неімунізованої тварини – в середньому 10 мг/мл. Для порівняння, концентрація ІgМ у сироватці складає 1,5 мг/мл. Препарати людських ІgG призначаються при імунодефіцитах та при важких вірусних захворюваннях.
 | |||
 | |||
 ІgА (15-20%сироваткових Іg)
ІgА (15-20%сироваткових Іg)
Міститься переважно у секретах слизових оболонок: слині, сльозах, поті, молозиві, секретах легенів, шлунково-кишкового тракту та сечо-статевих органів. Існує у вигляді димеру, поєднаного J-joint (єднальним) ланцюгом (15 кДа). У сироватцікрові ІgА присутній у мономерній формі. Відомі два підкласи ІgА: ІgАІ (80-90%) та ІgА2, у якого немає дисульфідних зв'язків між важкими і легкими ланцюгами. Аналогічно до ІgМважкий ланцюг ІgА містить С-кінцевий пептид з 18 а.з. з залишком цистеїну у передостанній позиції. Саме він є залученим у ковалентне зв’язування з J-ланцюгом при утворенні димеру.
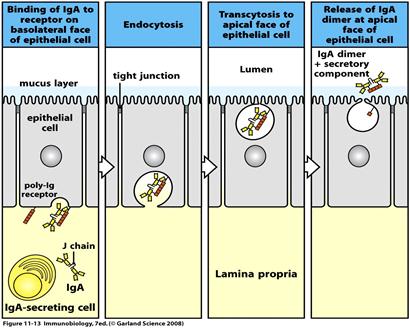
Секреторний sІgА існує у формі димера, чи навіть тримера. Містить крім J-ланцюга ще і секреторний компонент (поліпептидний ланцюг з Мм 60- 70 кДа). Отже ІgА, які синтезуються В-клітинами, зв’язуються попарно за рахунок J-ланцюга. Димери ІgА приєднуються до рецепторів (імуноглобулінові рецептори до зв’язаних J-ланцюгом полімерних імуноглобулінів) на базолатеральній поверхні епітеліальних клітин. Комплекси Іg-рецептор поглинаються шляхом ендоцитозу (інтерналізація), а утворенні ендосоми транспортуються до латеральної поверхні епітеліальної клітини, що межує з оточуючим середовищем. Цей процес отримав назву транцитозу. Після злиття ендосоми з цитоплазматичною мембраною на цьому боці клітини і виведенням комплексу на зовнішню поверхню мембрани відбувається протеоліз рецептора таким чином, що його частина лишається у складі комплексу, утворюючи секреторний компонент. Отже секреторний компонент - це частина рецептору до ІgА на епітеліальній клітині, через яку ІgА проходить із кровоносної чи лімфоїдної судини до слизових оболонок.
Секреторний компонент захищаєsІgА від протеолізу та подовжує його строк роботи. sІgАактивує комплемент і стимулює фагоцитарну реакцію у слизових.
 | |||
 | |||
 Рис.Сироваткова і секреторна формиІgА
Рис.Сироваткова і секреторна формиІgА
Секреторний ІgА є головним елементом захисної дії слизової оболонки від нападу мікроорганізмів, а слизові є потенційно найбільшими воротами захисту від інфекцій. До того ж у випадку зараження епітеліальних клітин вірусами ІgА,що транспортується крізь ентероцити, може нейтралізувати останні вже всередині цих клітин.
Рис. Механізм переносу sІgА через епітеліальну клітину
 | ||
 |
 |
ІgЕ( до 0,002 %сироваткових Іg)
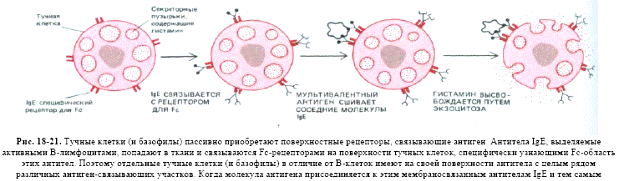
Міститься у сироватці крові, концентрація невелика. Є мономером, та як і для ІgМ,деμ- ланцюг містить чотири Сμ–домени, для ε-ланцюгів це також є характерним (72,5кДа, 550 а.з.). В цьому імуноглобуліні є додатковий Сн4 домен та відсутня шарнірна ділянка, роль якої виконує другий константний домен (Сн2-домен). Основна функція - індукція гострої реакції запалення шляхом звільнення медіаторів запалення: вазоактивних амінів - гістаміну та серотоніну - із тучних клітин в тканинах та базофілів крові. Саме ці клітини несуть на своїй поверхні Fс-рецептори до ІgЕ, а сам процес вивільнення запускається після взаємодії ІgЕ з антигеном. В нормі медіатори запалення викликають розширення кровоносних судин і підвищують проникність їх стінок, що сприяє притоку у місце інфекції (запалення) антитіл ІgG, комплементу, нейтрофілів, еозинофілів для ефективного подолання інфекції. Однак у цьому цілком нормальному механізмі часто трапляється збій, і тоді організм починає раптово відповідати надто сильно, неадекватно, на якийсь незначний і не небезпечний антиген типу пилку рослин чи бджолиної отрути. Тоді виникає алергійна реакція (гіперчутливості 1 типу): анафілактичний шок, сінна лихоманка, бронхіальна астма. ІgЕ - головні медіатори алергії. Також мастоцити і базофіли, як і еозинофіли, беруть участь у захисті організму проти гельмінтів.
 | |||||
 | |||||
 |
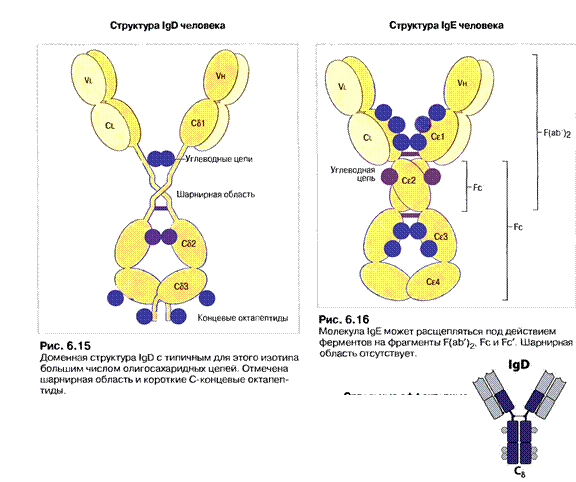 |
ІgD( 2 %сироваткових Іg)
Існують тільки умембранозв'язаній формі у вигляді рецепторів В лімфоцитів, які ще не зустрілись з антигеном. При розвиткуВ клітин з'являються після ІgМ. Мають видовжену шарнірну ділянку (70 а.з.), що забезпечує велику рухливість Fab фрагментів і тим самим сприяє ефективному зв’язуванню антигенів. До складу входять короткі С-кінцеві пептиди ("хвостики" на С-кінцях- 8-10 а.з.), збагачені великою кількістю олігоцукрів. ІgD здатні до спонтанного протеолізу, їмналежить значна роль в індукуванні дозрівання певних антитіл.
 |
Будова активного центру антитіл (за Скок М.)
Будову активного центру антитіл вивчали різними методами.
1. Фотоафінна та спінова мітка. Принцип: до антигену вводили хімічну групу, яка під дією опромінення утворювала ковалентні зв'язки із амінокислотними залишками, щоїї оточують. Потім комплекс антиген-антитіло гідролізували і визначали, із якою саме амінокислотою зв'язана мітка. Таким чином було знайдено, що у склад активного центру антитіла входять гіперваріабільні амінокислотні залишки.
2. Було помічено, що зв'язок антиген-антитіло руйнується при зміні рН, іонної силиі при додаванні органічних розчинників чи хаотропних іонів. Так було зроблено висновок, що зв'язок антигену з антитілом не ковалентний, а іонний, водневий чи гідрофобний.
3. Розміри активного центру вивчали за допомогою олігомерів амінокислот і вуглеводів різного розміру. Такбулознайдено, що в активному центрі антитіла може поміститися 5-6 залишків амінокислот чи глюкози і розміри активного центру становлять, відповідно, приблизно 15х6х8 Å = 1,5х0,6х0,8 нм(12х20Å ) і можуть варіювати у різних антитіл.
4. Те, що активний центр - це порожнина, заглиблена у Fv фрагмент, було знайдено за допомогою бівалентного гаптена (два дінітрофенола, розділених різною кількістю метиленових радикалів). При додаванні антитіл до такого антигену під електронним мікроскопом спостерігали характерні кільцеві структури, утворені збігом декількох молекул антитіл, що зв'язали антиген. Такі структури не утворювалися, якщо довжина спейсора була менше за 5(СН2), тобто активний центр був заглиблений у Fv- фрагмент приблизно на 15Å.
5. І, нарешті, у 70-ті роки було зроблено рентген-структурний аналіз мієломних імуноглобулінів, який підтвердив дані, отримані раніше, і показав, що активний центр антитіла - це порожнина, в утворенні якої беруть участь гіперваріабільні ділянки Fаb фрагменту, зближені у третинній структурі.
Таким чином, методом рентгеноструктурного аналізу кристалізованих білків було з’ясовано просторову будову варіабельних доменів і активного центру антитіл в цілому. На рис. показано просторову будову V- домену важкого ланцюга IgG людини (мієломного білка New). Упаковка в глобулу поліпептида, що є складовою V- домену, відбувається таким чином, що гіперваріабельні ділянки виявляються у безпосередній близькості один від одного з боку зовнішнього N-кінця. Каркасні ділянки VH- домену містять послідовності, що взаємодіють з тими ж послідовностями у VL –домені при утворенні АГ-зв'язуючого сайту. Отже в уворенні активного центру беруть участь VH- домен і VL –домен, що взаємодіють між собою. А взаємодія мієломного білка New з вітаміном К1ОН (γ-гідроксильованої форми вітаміну К) дозволила розрахувати розміри антигензв'язуючої порожнини для конкретного гаптена: глибина- 0,5-0,6 нм, довжина- 1,6 нм, ширина- 0,7 нм. Середні дані- глибина- 0,6-0,7 нм, довжина- 2,5-3,6 нм, ширина- 1,0-1,7 нм. До 10-12 амінокислотних залишків CDRs легкого і важкого ланцюга контактують з антигеном.
 |
 |
Детальні дослідження зв’язування мишачим антитілом D1.3 великого білкового антигену –лізоциму курячого яйця-показали, що АТ контактує з АГ через 17 амін.зал. З них 10 належало важкому, а 6(7) легкому ланцюгу. Вони належали до всіх CDRs, а особливо до CDR3 важкого ланцюга. Дві амінокислоти належали до каркасних ділянок. Площа контакту- 7,5 нм2, що складає 11% від поверхні АТ. Встановлено, що контактуючі поверхні так щільно підігнані, що були витіснені всі молекули води, що гідратували обидва білка. Це сприяло росту ентропії і підвищувало міцність утвореного комплексу.
 | |||
 |
Рис. Комплекс лізоциму курячого яйця
з антитілом D1.3. Фіолетові-важкі ланцюги;
легкі ланцюги-жовті; лізоцим-блакитний.
Червоним позначено залишок глютамінової
кислоти, що міститься між двома V- доменами
і утворює водневі зв’язки, що стабілізують
взаємодію АГ-АТ.
Основа високої специфічності антитіл полягає у відповідному розташуванні амінокислотних залишків в активному центрі; зміна заряду чи розмірів антигенної детермінанти зменшує ефективність зв'язування.
 |
В традиційних підручниках місце зв’язування антигену в молекулі імуноглобуліну представляють як рівчачок, чи кишеня, в яку занурений антиген. Однак кристалографічні дослідження з використанням рентгенівського випромінення показали, що тільки дуже малі антигени після зв’язування з антитілом можуть бути заглиблені у Fab ділянку. При зв’язуванні великих білкових антигенів поверхня контакту між фрагментом Fab антитіла і антигеном розтягнута і більш плоска. Деколи можна побачити на поверхні Fab фрагмента виступи, що входять в молекулу антигену. "Малий" антиген-флюоресцеїн, може заглибитись на 94% у Fab- фрагмент, а великі білкові АГ контактують з молекулою АТ лише кількома відсотками своєї поверхні.
На основі представлених вище даних можна охарактеризувати термін
паратоп- якділянку молекули імуноглобуліна, який вступає в безпосередній "хімічний" контакт з поверхнею антигенної детермінанти- епітопа. Отже паратоп виникає в разі зближення варіабельних ділянок в третинній і четвертинній структурі, причому всі 6 гіперваріабельних домени зближуються і утворюють стінки активного центру. Отже механістична модель активного центру:просторова відповідність виступу на молекулі АГ (АГ детермінанти) та впадини на поверхні АТ (антигензв'язуючої ділянки). Тільки при співпаданні цих просторових конфігурацій можливо утворення нековалентних взаємодій між епітопом і паратопом, які забезпечують зв’язування АГ/АТ.
Читайте також:
- Дефрагментація диска
- Дефрагментація дисків (Dfrg)
- Перевірка дисків, дефрагментація, відновлення системи, очистка диска. Форматування диска.
Переглядів: 1921
| <== попередня сторінка | | | наступна сторінка ==> |
| Типова молекула імуноглобуліну. Виділено структурну організацію легкого ланцюга імуноглобуліну | | | БУДОВА АКТИВНОГО ЦЕНТРУ АНТИТІЛ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |