
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Типова молекула імуноглобуліну. Виділено структурну організацію легкого ланцюга імуноглобуліну
Домени такої будови зустрічаються у багатьох рецепторних молекулах; їх так і називають - імуноглобуліноподібні домени..
Рис. Надродина імуноглобуліноподібних молекул, яка нараховує у людини приблизно 765 членів 
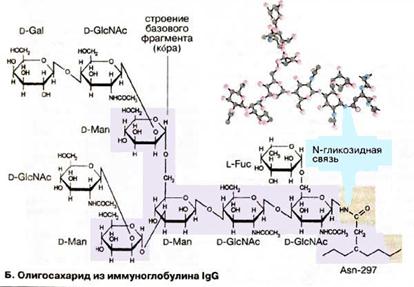
Імуноглобуліни - глікопротеїни, містять до 12% вуглеводів ( IgG - 2-3%), а саме манозу та галактозу,сіалову кислоту,які ковалентно включаються у пептидний ланцюг в районі СH2 домену через глікозидний зв'язок між аспарагіном і N-ацетилглюкозаміном. Ці компоненти приєднуються до молекули імуноглобуліну в процесі біосинтезу ланцюгів і в момент проходження через комплекс Гольджі. Вуглеводи підтримують функціональну конформацію доменів, захищають чутливі ділянки від пошкоджень протеолітичними ферментами і, можливо, беруть участь у транспортуванні і секреції імуноглобулінів.
Рис 4. Вуглеводні компоненти імуноглобулінів.
Олігоцукор (N-aцетилглюкозамін, манноза,галактоза), що зв’язаний N-глікозидним зв’язком з залишком аспарагіну у Fc фрагменті Ig G.
 |
При порівнянні амінокислотних послідовностей десятків мієломних білків було помічено, що найбільш змінні за амінокислотними залишками ділянки імуноглобулінів локалізовано у перших (N-кінцевих) доменах важкого і легкого ланцюгів. Саме вони отримали назву варіабільні (V-variable) домени. Відповідно, стали розрізняти константні домени з більш сталим амінокислотним складом (С-constant ). Так, легкий ланцюг складено із одного V і одного С доменів, а важкий - із одного Vі трьох ( μ-таε -ланцюги із чотирьох)С доменів. Їх позначають відповідно VL,VH, CL i СH. З одним набором С-доменів може бути об'єднано багато V-доменів. Клас імуноглобулінів визначається саме С доменом, тобто один V-домен може бути в складі як ІgМ, так і IgА, а імуноглобуліни одного класу можуть мати широкий спектр V-доменів (слайд).

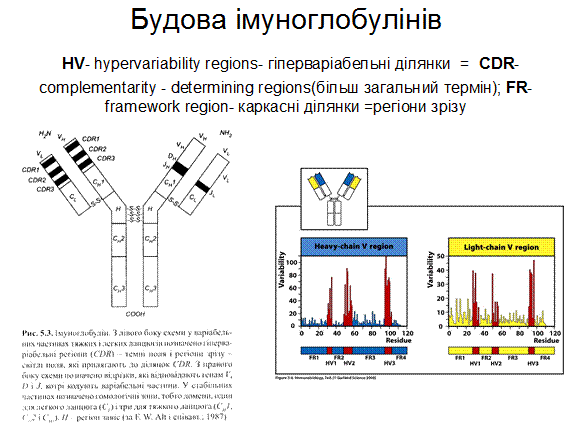
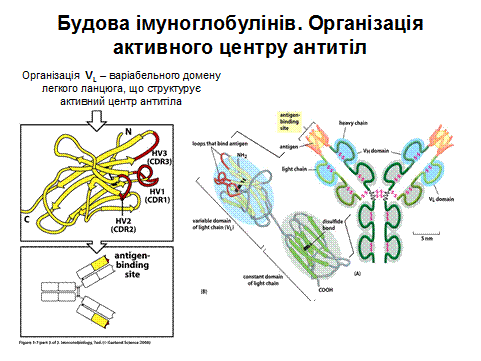
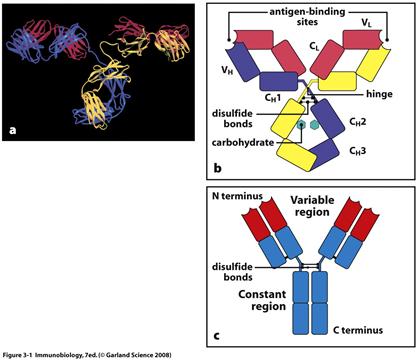
У складі V-доменів виділяють так звані гіперваріабільні ділянки, де заміни амінокислот зустрічаються частіше за інші. Їх ще називають СDRs (complementarity determining regions), тобто ділянки, що визначають комплементарність зв'язування з антигеном (гарячі точки антитіл). Саме ці ділянки входять до складу активного центру антитіла. Їх по три у важкому і легкому ланцюгах (CDR1, CDR2, CDR3). Ділянки між ними – каркасні (регіони зрізу - frame region= FR)- їх 4, саме вони визначають взаємне розташування СDRs. Структурно СDRs випетльовуються з β-складок, утворених каркасними ділянками. Завдяки симетричній структурі імуноглобуліну кожна молекула антитіла має два центри зв'язування з антигеном: між V-доменами важких і легких ланцюгів кожної пари, а саме між скомпонованими СDRs обох ланцюгів.
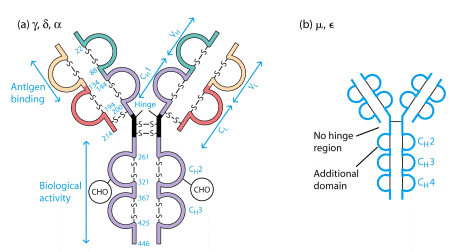
Четвертинний рівень організації імуноглобулінів
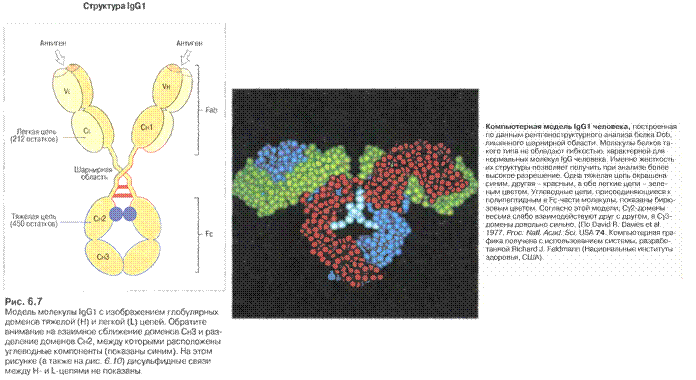
Два однакових Н- ланцюга орієнтовані в молекулі так, що їх С-кінці зближені і ланцюги закручені один відносно іншого ділянками, які містять домени Сн2, Сн3 і якщо є –Сн4. Між доменами існують як слабкі зв’язки, так і класичні ковалентні (S-S), що забезпечують фіксацію цих ділянок одна відносно іншої. Кількість S-S зв’язків і їх положення варіює залежно від класу і підкласу імуноглобуліну, але більшість з них розташована в районі других константних доменів.
 В трьох з п´яти Н-ланцюгів, а саме γ, δ, α, між Сн1та Сн2 доменами є багата на залишки проліну та цистеїну шарнірна ділянка, Hinge region, яка забезпечує рухомість "верхніх" частин молекули, що складаються з Сн1 і V доменів.
В трьох з п´яти Н-ланцюгів, а саме γ, δ, α, між Сн1та Сн2 доменами є багата на залишки проліну та цистеїну шарнірна ділянка, Hinge region, яка забезпечує рухомість "верхніх" частин молекули, що складаються з Сн1 і V доменів.
Рис.7.1. Будова антитіла . Структура IgG
 | |||
 |
В районі шарнірних ділянок фактично приєднуються ідентичні один одному легкі ланцюги, чиї N-кінці є тісно зближеними з N-кінцями важких ланцюгів, а С-кінець легкого ланцюга поєднаний з важким ланцюгом в районі Сн1 домена. Легкий ланцюг є жорстко фіксованим відносно важкого за рахунок слабких взаємодій, а також як мін 1 ковалентного S-S зв’язка між Сн1 і CL доменом. Єдиним виключенням є IgА2, який не містить такого міжланцюгового дисульфідного зв’язку. Отже рухомими є Сн1 і V домени легких і важких ланцюгів, що забезпечує умови для кращого зв’язування АГ.
Рис.7.2. Будова антитіла . Структура IgG1
 |
 |
Читайте також:
- Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями.
- Алкіни – вуглеводні, в молекулах яких є два атоми вуглецю, сполучені потрійним зв’язком - -. Алкіни називають також ацетиленовими вуглеводнями.
- Атипова пневмонія (5АК8)
- Бюджетний устрійпоказує, в який спосіб побудована бюджетна система. Іншими словами,він відображає організацію вертикальної структури бюджету держави за рівнями влади.
- Взаємодія йонів солі, що утворюються в результаті електролітичної дисоціації з молекулами води, називається гідролізом солі.
- Взаємодія між молекулами
- Взаємодія між молекулами.
- Вибір елементів ланцюга ослаблення поля
- Види засобів КЗІ залежно від способу їхньої реалізації, їх характеристика. Типова загальна схема шифратору
- Виділення ланцюга поставок із середовища
- ВИПРОМІНЮВАННЯ ТА ПОГЛИНАННЯ ЕНЕРГІЇ АТОМАМИ ТА МОЛЕКУЛАМИ
- Витрати на організацію робіт на будівельних майданчиках і удосконалення технології
Переглядів: 1697
| <== попередня сторінка | | | наступна сторінка ==> |
| Лекція 4. Антитіла, їх будова і властивості. | | | Протеолітична фрагментація імуноглобулінів. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |