
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Основні закони хімії.
Закон збереження маси: загальна маса речовин, які вступають у хімічну реакцію, дорівнює загальній масі речовин, що утворюються внаслідок реакції.
Закон сталості складу: кожна чиста речовина молекулярної будови має сталий склад, що не залежить від місця та способу її добування. (Для речовин немолекулярної будови може не виконуватися).
Закон простих об’ємних співвідношень: співвідношення об’ємів газів, що вступають у реакцію або утворюються внаслідок неї, є співвідношенням простих цілих чисел.
Закон Авогадро: у рівних об'ємах різних газів за однакових умов міститься однакове число молекул.
Наслідок з закону Авогадро: однакови число молекул різних газів за однакових умов займає один і той самий об’єм.
До основних понять хімії відносяться: хімічний елемент, атом, молекула, проста речовина, складна речовина, алотропія, валентність, ступінь окиснення.
Хімічний елемент - це вид (набір) атомів, що характеризуються визначеною величиною заряду ядра (при цьому маса атомів може бути різною).
Атом - це найменша частинка хімічного елемента, яка є носієм його властивостей. З точки зору структури, атом - електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
Молекула - це найменша частинка речовини, що є носієм її хімічних властивостей. До складу молекули можуть входити атоми одного чи кількох хімічних елементів, з’єднанних між собою хімічними зв’язками.
Валентність – здатність атомів вступати в хімічний зв’язок з певною кількістю інших атомів.
Ступінь окислення – умовний заряд атома в молекулі, який розраховано в припущені, що сполука складається з йонів.
Прості речовини – складаються з атомів одного хімічного елемента (наприклад, О2 - кисень, Н2 - водень, Ar - аргон, Cl2 - хлор, Р - фосфор тощо).
Алотропія – явище існування хімічного елемента у вигляді декількох простих речовин (наприклад, О2 - кисень, О3 - озон; вуглець – алмаз і графіт).
Складні речовини - складаються з атомів різних хімічних елементів (H2O, CO2, NH3, C2H5OH).
Відносною молекулярною Мr (або атомною Аr) масою речовини називають відношення маси молекули (або атома) т0 даної речовини до 1/12 маси атома Карбону-12 т0(С);
Моль — це така кількість речовини, яка містить стільки молекул, атомів, йонів або інших структурних одиниць, скільки міститься атомів у 0,012 кг нукліда Карбону 12С.
Число структурних одиниць, що міститься в одному молі будь-якої речовини, називають числом Авогадро. Число Авогадро становить 6,02•1023.
Кількість речовини можна розрахувати за формулами:

Крім відносної молекулярної маси Мr, у хімії та фізиці широко застосовують поняття “молярна маса ”.
Молярною масою (M) називають масу речовини, взятої в кількості один моль.
М=m/n
Моль будь-якого газу за нормальних умов займає об'єм 22,4 л. Цей об'єм називається молярним об 'ємом газу.
Рівняння Клапейрона – Менделєєва:
PV = (m/M)RT.
де Р – тиск, Па; V – обєм, м3; m – маса, г;M – молярна маса, г/моль; Т – температура, К; R – універсальна газова стала, що дорівнює 8,314 Дж/(моль К).
В деяких випадках зручно користуватися об'єднаним газовим законом:
PV/T = const ,або Р1V1/T1 = Р2V2/T2, або PV/T= P0V0/T0
де P0= 101,3 кПа; T0= 273 К.
Для фахівців з пожежної безпеки важливими є питання пов’язані зі знанням характеристик процесу горіння.
Горіння - це фізико-хімічний процес, для якого характерні три ознаки: хімічне перетворення, виділення тепла та випромінювання світла. Дві з них - це предмет вивчення хімії.
Приклад 1.
Визначити простішу формулу оксиду сірки, якщо відомо, що масова частка сірки в цьому оксиді складає 40%.
Розв’язання.
1.Візьмемо 100 г оксиду сірки. Маса сірки та кисню буде складати:
m(S) = m(оксиду) × w(S) = 100 × 0,4 = 40 г
m(О) = m(оксиду) × w(О) = 100 × 0,6 = 60 г
2. Розрахуємо відповідні кількості молей сірки та кисню:
n(S) = m(S)/M(S) = 40/32 = 1,25 моль,
n(О) = m(О)/M(О) = 60/16 = 3,75 моль.
3.Визначимо відношення кількості сірки та кисню.
n(S)/n(O) = 1,25/3,75; або в цілих числах:
n(S)/n(O) = 1:3.
Тобто простіша формула оксиду сірки SO3.
Приклад 2.
Обчислити молярну масу газу, якщо за нормальних умов маса 0,112 л цього газу дорівнює 0,22 г.
Розв'язання.
Згідно з рівнянням Клапейрона - Менделєєва:
P ´ V = (m/M) ´ R ´ T; M = m ´ R ´ T /(P ´ V),
де М - молярна маса, г/моль; m - маса газу, г; V - об'єм газу, ( м3 ); P - тиск, Па; T - температура, К.
M = 0.22´8.314´298/(101.3´103´0.12´10–3) = 44.0 г/моль.
Приклад 3.
Обчислити об'єм кисню, який потрібний для згоряння 1 кг бензолу, якщо температура 20° С, тиск 99992 Па.
Розв'язання.
1). Складаємо рівняння реакції горіння бензолу.
2C6H6 + 15O2 = 12CO2 + 6H2O
або в розрахунку на 1 моль бензолу:
C6H6 + 7,5 O2 = 6CO2 + 3 H2O
Згідно з рівнянням реакції, на один моль бензолу витрачається 7,5 молей кисню.
М(бензолу)=12´6+1´6=78 г/моль
78 г бензолу потребує 7,5 молей кисню
1000 г бензолу потребує n молей кисню
n = 1000 ´7,5/78 = 96,2 молей кисню
2). Об'єм кисню розрахуємо згідно з рівнянням Клапейрона - Менделєєва:
V = n´R´T/P = 96.2´8.314´293/99992 = 2,34 м3.
Приклад 4.
Природний магній складається з трьох нуклідів з нуклонними числами 24, 25 і 26, вміст яких складає 78,6%, 10,1% і 11,3% відповідно.
Визначити відносну атомну масу магнію.
Розв’язання.
Відносна атомна маса – це середнє значення атомних мас природної суміші ізотопів.
Нехай загальна кількість атомів магнію – N.Тоді нуклідів магнію з нуклонними числами 24, 25 і 26 буде відповідно: 0,786žN, 0,101žN і 0,113žN. Їх маси будуть складати: 0,786ž24žN, 0,101ž25žN і 0,113ž26žN. Середня маса дорівнює:
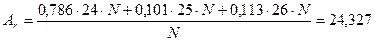
Приклад 5.
Виразити масу молекули води в грамах.
Розв’язання.
Молярна маса води дорівнює 18 г/моль. Відомо, що один моль будь якої речовини містить 6,02ž1023 молекул. Тоді маса однієї молекули води буде дорівнювати:
m(молекули) = М(Н2О) / 6,02ž1023 = 18 / 6,02ž1023 = 2,99 ž10 –23 г.
Запитання для самоконтролю
1. Що вивчає хімія? В чому суть хімічних перетворень?
2. Що таке атом, молекула, хімічний елемент?
3. Що таке молярна маса і молекулярна маса?
4. Що таке кількість речовини?
5. Що таке молярний об’єм? За яких умов він вимірюється?
6. Сформулюйте закон Авогадро. Які наслідки випливають з нього?
7. Для яких речовин справедливий закон сталості складу речовини?
8. Який процес називається процесом горіння?
Читайте також:
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- II. Основні засоби
- II.3. Основні способи і прийоми досягнення адекватності
- IV. Закони ідеальних газів.
- VII. ОСНОВНІ ЕТАПИ РОЗВИТКУ УКРАЇНСЬКОЇ КУЛЬТУРИ У ХХ ст.
- А) Грошовий обіг. Закони.
- Аграрні закони України
- Адвокатура в Україні: основні завдання і функції
- Амортизація основних засобів, основні методи амортизації
- Артеріальний пульс, основні параметри
- Артеріальний пульс, основні параметри
- Б) основні джерела забруднення атмосферного повітря.
| <== попередня сторінка | | | наступна сторінка ==> |
| ВСТУП. Тема 1. Основні поняття і закони хімії | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |