
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Перші моделі атома
 У ході вивчення катодного випромінювання і радіоактивності виявилося, що до складу атомів елементів входять електрони. Оскільки атоми електронейтральні, то вони повинні мати стільки позитивних зарядів, скільки міститься в них електронів. З’ясуємо, як же розміщуються в атомі електрони й позитивні заряди.
У ході вивчення катодного випромінювання і радіоактивності виявилося, що до складу атомів елементів входять електрони. Оскільки атоми електронейтральні, то вони повинні мати стільки позитивних зарядів, скільки міститься в них електронів. З’ясуємо, як же розміщуються в атомі електрони й позитивні заряди.
|
негативно заряджені електрони. Виходячи з розміщення елементів у періодичній системі Д.І.Менделєєва і періодичної зміни їх хімічних властивостей Томсон припустив, що електрони в атомі розміщуються пошарово й хімічні властивості елементів зумовлені зовнішнім шаром електронів. Така модель атома трактувала тільки деякі його властивості (випромінювання, розсіювання, поглинання світла). Багато експериментальних даних, зокрема досліди Резерфорда, модель Томсона пояснити не могла.
Для перевірки цієї моделі та більш точного визначення внутрішньої будови атома Резерфорд провів серію дослідів з a-частинками, які утворюються в результаті радіоактивного розпаду. Він спрямував a-частинки, спостерігаючи за їх рухом, на тоненькі металеві пластинки (рис. 7). Учений встановив, що переважна більшість a-частинок проникала крізь металеві пластинки, деякі з них відхилялись під кутом від прямолінійного напряму руху і тільки незначна кількість (1 частинка із 10 000) була відкинута у вихідне положення. Проходження a-частинок через металеву пластинку і відкидання від неї неможливо пояснити з позиції моделі атома Томсона. Справді, a-частинка, яка має подвійний позитивний заряд і значну масу, під час її швидкого руху може бути відкинута у вихідне положення лише тоді, коли зіткнеться зі значно більшим позитивним зарядом. Крім того, проходження великої кількості a-частинок крізь металеву пластинку є доказом того, що атом майже “порожній” і має дискретну будову.
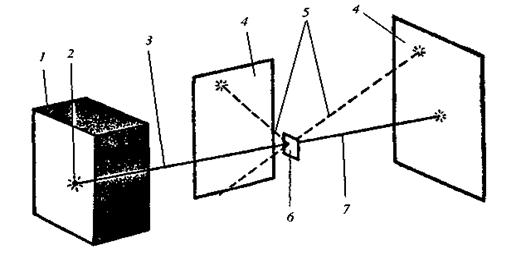 |
Рис. 7. Схема досліду Резерфорда:
1 – свинцева скринька; 2 – препарат Радію; 3 – пучок a-частинок; 4 – екран; 5 – проміння a-частинок, що відхилилися на невеликі кути або різко змінили напрям руху; 6 – тонка металева пластинка; 7 – a-частинки, які не змінили свій напрямок
На основі своїх дослідів Резерфорд у 1911 р. запропонував ядерну модель атома. Відповідно до неї в центрі атома міститься позитивно заряджене ядро, маса якого майже дорівнює масі атома, навколо ядра рухаються електрони, число яких дорівнює позитивному заряду ядра. Між ядром і електронами взаємодіють електростатичні (кулонівські) сили, зрівноважені відцентровою силою, що виникає внаслідок руху електронів. Якщо сила кулонівського притягання до ядра дорівнює  , а відцентрова сила
, а відцентрова сила  , то
, то
 = =  , ,
| (2) |
де m – маса електрона; v – швидкість руху електрона; e – заряд електрона; r – радіус орбіталі, по якій рухається електрон.
Досліди з a-частинками дали змогу Резерфорду оцінити величину заряду ядер різних атомів. Результати обчислень показали, що заряд ядра атома чисельно дорівнює порядковому номеру елемента в періодичній системі. Атоми елементів нейтральні, а тому кількість електронів у кожному з них також дорівнює відповідному порядковому номеру елемента.
Велике значення у встановленні заряду ядра атома мали дослідження учня Резерфорда англійського фізика Мозлі.
Читайте також:
- CMM. Визначення моделі зрілості.
- ISO 15504.Структура еталонної моделі
- IV. Хто переміг у боротьбі за першість
- Автокореляція залишків – це залежність між послідовними значеннями стохастичної складової моделі.
- Адміністративний поділ, площа і населення українських земель у складі Речі Посполитої в першій воловині ХVІІ ст.
- Адміністративно-територіальний устрій, економічне становище українських земель у першій половині ХІХ ст.
- Адміністративно-територіальний устрій, економічне становище українських земель у першій половині ХІХ ст.
- Алгоритм реалізації моделі
- Алгоритм реалізації моделі
- Алгоритм реалізації моделі
- Алгоритм реалізації моделі
- Алгоритм реалізації моделі
| <== попередня сторінка | | | наступна сторінка ==> |
| Та її експериментальне доведення | | | Атомні спектри |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |