
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Принцип Паулі. Стани електронів у складних атомах
7.8.1. Отже, електрони в атомі описуються четвіркою квантових чисел: головне квантове число n, орбітальне квантове число 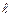 , магнітне квантове число
, магнітне квантове число 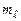 і магнітне спінове квантове число
і магнітне спінове квантове число 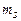 . У воднеподібних атомів енергія електрона залежить лише від головного квантового числа. В складних, багатоелектронних атомах окремий електрон перебуває в полі не тільки ядра, але і решти електронів. Це призводить до зняття виродження по
. У воднеподібних атомів енергія електрона залежить лише від головного квантового числа. В складних, багатоелектронних атомах окремий електрон перебуває в полі не тільки ядра, але і решти електронів. Це призводить до зняття виродження по 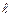 , і енергія електрона залежить як від n, так і від
, і енергія електрона залежить як від n, так і від 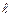
 . При цьому, як правило, залежність від n сильніша.
. При цьому, як правило, залежність від n сильніша.
Якщо багатоелектронний атом перебуває в незбудженому стані, то його електрони намагатимуться зайняти стани з мінімальною енергією (стан стійкої рівноваги). Таким є стан 1s (n = 1; 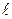 = 0). Але реалізувати таку ситуацію забороняє принцип Паулі (1925 р.), справедливий лише для ферміонів: в системі тотожних ферміонів в певному стані може перебувати лише одна частинка. Оскільки електрони є ферміонами, то цей принцип стосовно електронів в атомі формулюється наступним чином: лише один електрон в атомі може володіти тотожним набором чотирьох квантових чисел:
= 0). Але реалізувати таку ситуацію забороняє принцип Паулі (1925 р.), справедливий лише для ферміонів: в системі тотожних ферміонів в певному стані може перебувати лише одна частинка. Оскільки електрони є ферміонами, то цей принцип стосовно електронів в атомі формулюється наступним чином: лише один електрон в атомі може володіти тотожним набором чотирьох квантових чисел: 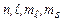 . А це означає, що в стані 1s може перебувати лише два електрони з протилежними спінами (
. А це означає, що в стані 1s може перебувати лише два електрони з протилежними спінами ( ), решта електронів повинна перебувати в інших станах. Для опису розподілу Z електронів незбудженого багатоелектронного атома по станах введемо поняття шарів і оболонок.
), решта електронів повинна перебувати в інших станах. Для опису розподілу Z електронів незбудженого багатоелектронного атома по станах введемо поняття шарів і оболонок.
До шару належать електрони, які мають однакове головне квантове число n. Максимальна кількість електронів в шарі – 2n2. Шари класифікуються як: К(n = 1), L(n = 2), M(n = 3), N(n = 4) тощо. До оболонки належать електрони, які мають однакові квантові числа n і  . Максимальна кількість електронів в оболонці – 2(2
. Максимальна кількість електронів в оболонці – 2(2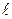 +1). Оболонки класифікуються як: 1s(n = 1,
+1). Оболонки класифікуються як: 1s(n = 1,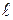 = 0), 2s(n = 2,
= 0), 2s(n = 2,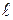 = 0), 2p(n = 2,
= 0), 2p(n = 2,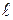 = 1) тощо. Електронна конфігурація, наприклад, атома міді, який має 29 електронів, представлена наступним чином:
= 1) тощо. Електронна конфігурація, наприклад, атома міді, який має 29 електронів, представлена наступним чином:
1s2 2s2 2p6 3s2 3p6 3d10 4s1.
Тут цифри над символами оболонок вказують на кількість електронів в них. Видно, що К-шар вміщує лише одну оболонку, інші шари мають по декілька оболонок.
6.8.2. Взаємодія між електронами складних атомів зумовлена як чисто електростатичними силами, так і магнітними силами, оскільки кожен електрон володіє як орбітальним, так і спіновим магнітним моментом. Остання взаємодія називається спін-орбітальною.
Якщо електростатична взаємодія сильніша від спін-орбітальної, то реалізується зв’язок Рассель-Саундерса, при якому спочатку сумуються окремо орбітальні, окремо спінові моменти усіх електронів атома (оболонки, шару), тобто
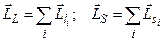 .
.
А сумарний (повний) момент електронів атома (оболонки, шару) 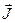 шукається як векторна сума орбітального і спінового моментів, тобто
шукається як векторна сума орбітального і спінового моментів, тобто
 .
.
Квадрат цих векторів виражається через відповідні квантові числа L, S, J наступними співвідношеннями:
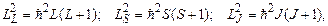 (7.60)
(7.60)
де L – орбітальне квантове число атома (оболонки, шару), яке приймає цілочисельні значення між максимальним і мінімальним значенням алгебраїчної суми  , S – спінове квантове число атома (оболонки, шару), яке приймає значення між максимальним і мінімальним значенням алгебраїчної суми
, S – спінове квантове число атома (оболонки, шару), яке приймає значення між максимальним і мінімальним значенням алгебраїчної суми 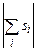 , J – внутрішнє квантове число атома (оболонки, шару), яке може приймати значення від
, J – внутрішнє квантове число атома (оболонки, шару), яке може приймати значення від 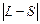 до L + S. Наприклад, для частково заповненої оболонки np2 вказані квантові числа можуть приймати значення: L = 0, 1, 2; S = 0, 1; J = 0, 1, 2. Відмітимо, що одночасно не може реалізуватися ситуація, в якій L = 2 i S = 1, (а, отже, J = 3), бо при цьому порушиться принцип Паулі.
до L + S. Наприклад, для частково заповненої оболонки np2 вказані квантові числа можуть приймати значення: L = 0, 1, 2; S = 0, 1; J = 0, 1, 2. Відмітимо, що одночасно не може реалізуватися ситуація, в якій L = 2 i S = 1, (а, отже, J = 3), бо при цьому порушиться принцип Паулі.
Стани з різними можливими значеннями квантових чисел L, S, J називаються термами, які позначаються символічно як  , де замість числового значення L пишуть відповідну велику букву S(L = 0), P(L = 1), D(L = 2) тощо. Для наведеного прикладу можливими є наступні терми:
, де замість числового значення L пишуть відповідну велику букву S(L = 0), P(L = 1), D(L = 2) тощо. Для наведеного прикладу можливими є наступні терми: 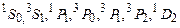 . Зрозуміло, що основний стан оболонки, тобто стан з мінімальною енергією, реалізується через один з наведених термів (в даному випадку таким є терм
. Зрозуміло, що основний стан оболонки, тобто стан з мінімальною енергією, реалізується через один з наведених термів (в даному випадку таким є терм 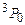 ). Усі інші терми характеризують збуджені стани.
). Усі інші терми характеризують збуджені стани.
Зв’язок Рассель-Саундерса реалізується в більшості атомів. Але для деяких великих атомів спін-орбітальна взаємодія сильніша від електростатичної. В цьому випадку реалізується зв’язок (jj), при якому спочатку додаються векторно орбітальний і спіновий моменти окремих електронів, утворюючи повний момент і-го електрона

а сумарний повний момент атома (оболонки, шару) визначається як векторна сума повних моментів окремих електронів:
 (7.61)
(7.61)
де J – знову ж внутрішнє квантове число атома (оболонки, шару).
Розрахунок згадуваних моментів атомів полегшується тим, що для повністю заповненої оболонки ці моменти дорівнюють нулю. Проілюструємо це для p-оболонки атома зі зв’язком Рассель-Саундерса, використавши сумування проекцій моментів на вісь z, тобто використовуючи квантові числа 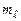 і
і 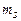 усіх електронів p-оболонки, з урахуванням принципу Паулі. Дійсно:
усіх електронів p-оболонки, з урахуванням принципу Паулі. Дійсно:
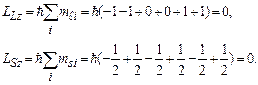
В такому разі стан атома визначається електронами частково заповнених оболонок. В більшості атомів внутрішні оболонки (1s, 2s, 2p, …) заповнені повністю, а частково заповнена лише зовнішня оболонка (хоч і є винятки). Електрони зовнішніх оболонок найслабше зв’язані зі своїм ядром і тому забезпечують зв’язок між атомами в молекулах і в кристалічних гратках твердих тіл. Такі електрони називаються валентними, вони відповідальні за спектри випромінювання і поглинення атомів.
Читайте також:
- Аграрна політика як складова економічної політики держави. Сутність і принципи аграрної політики
- Агрегатні стани речовини
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
- Аналогія права - вирішення справи або окремого юридичного питання на основі принципів права, загальних засад і значення законодавства.
- Антикорупційні принципи
- АРХІВНЕ ОПИСУВАННЯ: ПОНЯТТЯ, ВИДИ, ПРИНЦИПИ І МЕТОДИ
- Б/. Принципи виборчого права.
- БАЖАННЯ і НАМІРИ - це миттєво виникаючі і досить часто змінюють один одного мотиваційні суб'єктивні стани, що відповідають змінюваних умов виконання дії.
- Базові принципи обліку виробничих витрат і калькулювання собівартості продукції
- Базові принципи психології спорту.
- Банківська система: сутність, принципи побудови та функції. особливості побудови банківської системи в Україн
- Банківська система: сутність, принципи побудови та функції. Особливості побудови банківської системи в Україні.
| <== попередня сторінка | | | наступна сторінка ==> |
| | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |