
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ШЛЯХИ ДОСЛІДЖЕННЯ МЕХАНІЗМУ РЕАКЦІ.
Практично неможливо отримати детальну інформацію про структурні, енергетичні і стехіометричні параметри, які характеризують перехідний стан, через який проходить хімічна реакція. Але часто вдається зібрати достатньо інформації про перехідний стан і показати, що такий механізм реакції можливий.
Найбільше інформації про механізм реакції можна отримати при вивченні кінетики реакції. Найважчим етапом роботи є інтерпретація отриманих даних. Це пов’язано з тим, що ефективна концентрація діючої частинки може суттєво відрізнятися від концентрації реагентів, яку ми можемо безпосередньо визначити. Так, під час реакції нітрування ефективною діючою частинкою є нітроній-катіон NO2+, концентрація якого є складною функцією від концентрації HNO3, яку безпосередньо ми можемо визначити.
Швидкість гомогенної реакції визначається швидкістю витрати реагентів або швидкістю появи продуктів реакції. Майже завжди швидкість реакції змінюється в часі, так як звичайно вона пропорційна концентрації, а концентрація реагентів з часом зменшується. В деяких випадках зміна концентрації деякого реагента не впливає на швидкість, в деяких випадках швидкість може бути пропорційна концентрації речовини (наприклад, каталізатора), яка навіть не фігурує в стехіометричному рівнянні. Тому вивчення характеру впливу концентрації реагентів на швидкість реакції, часто багато може сказати про механізм реакції.
Якщо швидкість пропорційна зміні концентрації тільки одного реагента А, закон швидкості має вигляд:
 ,
,
де коефіцієнт k – константа швидкості реакції. Знак мінус означає, що концентрація A зменшується в часі. Реакції, які відповідають приведеному рівнянню швидкості, називають реакціями першого порядку. Одиницею вимірювання k в реакціях першого порядку служить c-1. Швидкість реакції другого порядку пропорційна концентрації двох реагентів або квадрату концентрації одного реагента:

Одиницею вимірювання k в реакції другого порядку служить лּмоль-1ּс-1 або інші величини, які виражають зворотню величину концентрації або тиску за одиничний інтервал часу. Аналогічний вираз можна записати і для реакцій третього порядку. Якщо швидкість реакції пропорційна [A] і [B], говорять, що реакція має перший порядок по A і B і другий загальний порядок. Швидкість реакції можна вимірювати як по продуктах реакції, так і по реагенту, але виміряні таким чином швидкості реакції не завжди однакові.
Закон швидкості реакції – це експериментально встановлений факт. З нього намагаються дізнатися молекулярність реакції, яку можна визначити як число молекул, які об'єднуються для утворення активованого комплексу. Якщо вдається дізнатися, скільки молекул і яких приймають участь в утворенні активованого комплексу, це може багато говорити про механізм реакції. Експериментально встановлений порядок реакції необов'язково співпадає з молекулярністю. Будь-яка реакція незалежно від того, скільки стадій вона включає, підлягає тільки одному закону швидкості, але кожна стадія механізму має свою власну молекулярність. Для одностадійних реакцій (які проходять без утворення інтермедіатів) порядок, це те саме, що молекулярність. Одностадійна реакція першого порядку завжди мономолекулярна; одностадійна реакція другого порядку по A завжди включає дві молекули A; якщо реакція має перший порядок по A і B, молекула A реагує з одною молекулою B. Якщо реакція проходить у дві або кілька стадій, порядок кожної стадії – це те саме, що молекулярність тієї ж стадії. Якщо одна зі стадій механізму протікає значно повільніше всіх інших, тоді швидкість реакції по суті буде такою ж, як швидкість самої повільної стадії, яку називають лімітуючою стадією або стадією, що визначає швидкість реакції.
Всі багатостадійні реакції можна розділити на дві групи.
1. Перша стадія повільніша, ніж всі наступні, і тому лімітуюча. В таких випадках закон швидкості включає реагенти, які приймають участь в повільній стадії. Наприклад, якщо реакція A + 2B →C має механізм
повільно
 A + B I;
A + B I;
швидко
 I + B C,
I + B C,
де I – інтермедіат, – це реакція другого порядку, і закон швидкості має вигляд
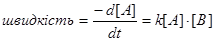
2. Якщо перша стадія не є лімітуючою, вивести закон швидкості набагато складніше. Розглянемо, наприклад, механізм
k1
Стадія 1 A + B ↔ I
k2
Стадія 2 I + B → C
де на першій стадії швидко встановлюється рівновага, після чого наступає друга повільна стадія, яка приводить до утворення продукта реакції C. Швидкість витрати реагента A описується виразом:
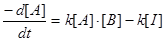
Цей вираз включає два члени, оскільки A не тільки витрачається, але і утворюється по зворотній реакції. Таке рівняння малокорисне, оскільки концентрація I невідома. Запишемо закон швидкості для інтермедіата I:
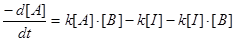
Введемо припущення, що концентрація I не змінюється в часі, оскільки інтермедіат витрачається і утворюється з однаковою швидкістю. Таке припущення, яке називають стаціонарним станом, дозволяє прирівняти вираз dI/dt нулю і знайти [I] через [A] і [B]:
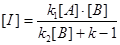
Тоді: 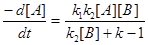
Необхідно відмітити, що цей закон швидкості справедливий при будь-яких значеннях k1, k2, k-1. Але спочатку наші роздуми базувалися на гіпотезі, що перша стадія швидша, ніж друга, тобто
k1 [A]ּ[B] >> k2 [I]ּ[B]
Оскільки перша стадія являє собою рівновагу
k1 [A]ּ[B] = k-1 [I]
і значить
k-1 [I] >> k2 [I]ּ[B] або k-1 >> k2 [B]
Таким чином величиною k2 [B] можна знехтувати, і тоді

Загальна швидкість реакції має третій порядок, перший по A і другий по B. Якщо перша стадія лімітуюча, тоді
k2 [B] >> k-1 і 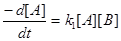
тобто ми отримали той же закон швидкості, який було виведено для випадку лімітуючої першої стадії і який включає тільки регенти, що приймають участь у цій стадії.
В лімітуючій стадії реакції можуть приймати участь реагенти A і B, хоча в рівнянні реакції появляється тільки A. Це відбувається при великому надлишку B, нехай 1:100, при цьому на реакцію витрачається тільки 1 моль B, решта в реакцію не вступає. В таких випадках дуже важко виміряти зміну концентрації B. Оскільки концентрація B практично не змінюється, реакція має уявний перший порядок тільки по A, хоча насправді в лімітуючій стадії приймає участь A і B. Такі реакції називають реакціями псевдопершого порядку. Псевдопорядок появляється і у випадку участі в реакції каталізатора, в буферних розчинах, в розчинах B. Умови псевдопершого порядку часто використовуються в кінетичних дослідженнях для зручності проведення експерименту і розрахунків. Реальному вимірюванню піддаються компоненти, які не перебувають у надлишку. Для цього використовують наступні методи:
1. Періодичний або неперервний запис спектру.
2. Зупинка реакції і аналіз реакційної маси.
3. Відбір проб через певні проміжки часу.
4. Для газових реакцій вимірювання загального тиску.
5. Калориметричні методи. Через певні проміжки часу вимірюють кількість тепла, яке виділилося або поглинулося.
Для кінетичних вимірювань швидких реакцій існують спеціальні методи. В результаті таких вимірювань отримують графік залежності концентрації від часу. Отримані дані необхідно правильно інтерпретувати. Якщо реакція проходить по простій кінетиці першого і другого порядку, інтерпретація не викликає затруднень. Наприклад, якщо в початковий момент часу концентрація реагента була A0, тоді рівняння швидкості першого порядку:
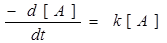 або
або 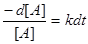
після інтегрування від t=0 до t=t отримуємо:

або 
Якщо графік залежності ln[A] від t лінійний, реакція має перший порядок і величину k можна знайти по нахилу прямої. Часто приводять величину напівперетворення:

З кінетичних даних можна отримати різного типу інформацію про механізм реакції.
1. По порядку реакції можна судити про те, які молекули і в якій кількості приймають участь в лімітуючій стадії.
2. Дуже корисними є дані про самі константи швидкості, оскільки по них можна судити про вплив на швидкість таких факторів як будова реагентів, природа розчинника, іонна сила, каталізатор і т.д.
3. При вимірюванні константи швидкості при різних температурах отримують лінійний графік залежності lnk від 1/T, який відповідає рівнянню:
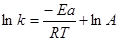 ,
,
де R – газова постійна, А – константа, яку називають частотним фактором, Ea – арреніусовська енергія активації реакції.
Значний вплив на швидкість реакції має і характер розчинника, особливо у тому випадку коли проміжні сполуки мають полярну природу і навколо них можуть певним чином розташовуватися молекули розчинника. Характер подібного оточення залежить від складу і природи розчинника, особливо від полярності і сольватуючої здатності.
У випадку радикальних реакцій характер розчинника менш сильно впливає на швидкість реакції. Більше значення має присутність речовин, які можуть перетягувати або зв’язувати радикали.
Для вирішення питання про стадію, на якій проходить розрив зв’язку, дає вивчення ізотопного ефекту. Так, для рішення питання чи являється розрив звязку С–Н лімітуючою стадією реакції необхідно вивчити і порівняти швидкість реакції речовини і її ізотопної форми, в якій водень замінено на дейтерій. Зв'язок C–D завжди міцніший звязку C–H і, якщо стадія розриву цього зв’язку лімітуюча, спостерігається семикратне сповільнення реакції. Коли ж швидкість реакції практично не залежить під ізотопного складу речовини, можна говорити, що стадія відриву протону не лімітує процес (наприклад реакція нітрування).
Ізотропні ефекти є цінним діагностичним інструментом для визначення механізму реакції. Наприклад, той факт, що швидкість бромування ацетону
CH3COCH3 + Br2 → CH3COCH2Br
не залежить від концентрації брому, приводить до думки про те, що лімітуючою стадією реакції є таутомеризація ацетону:
OH-
 CH3COCH3 CH3–C=CH2
CH3COCH3 CH3–C=CH2
В свою чергу лімітуючою стадією таутомеризації є розрив зв’язку C–H. Тому при бромуванні дейтерованого ацетону повинен спостерігатися значний ізотопний ефект. Дійсно, було знайдено, що величина Kh/Kd складає близько 7. Звичайно ізотопні ефекти дейтерію змінюються від 1 (відсутність ефекту) до 7-8, хоча в деяких випадках спостерігались і значно більші величини. Значення Kh/Kd менші 1 називають зворотнім ізотопним ефектом. Максимальні ізотопні ефекти спостерігаються в тих випадках, коли в перехідному стані водень симетрично зв’язаний з атомами, між якими здійснюється його переміщення. Розрахунки також показують, що ізотопні ефекти найбільші, якщо водень в перехідному стані розміщується на прямій, яка з’єднує два атоми, між якими здійснюється його переміщення, і що у випадку достатньо нелінійних конфігурацій величина ізотопного ефекту зменшується і приймає значення від 1 до 2.
Найбільш конкретну інформацію про механізм реакції вдається отримати в тому випадку, коли вдається реально отримати і виділити проміжні сполуки, які утворюються по ходу реакції. Для більшості реакцій не вдається виділити такі проміжні сполуки, але це не означає що їх в дійсності немає. Просто вони недостатньо стабільні в даних умовах. В такому випадку необхідно вводити в реакцію сполуки, які легко вступають в характерні реакції з такими проміжними речовинами.
В багатьох випадках механізм реакції передбачає утворення інтермедіатів. Існує кілька методів, які допомагають розпізнати чи дійсно в реакції утворюється інтермедіат, і якщо так, то спробувати встановити його структуру.
1. Виділення інтермедіата. Іноді вдається виділити інтермедіат з реакційної маси, зупинивши реакцію через деякий проміжок часу або проводячи реакцію в дуже м’яких умовах. Наприклад, було виділено інтермедіат RCONHBr, який утворюється в реакції:
RCONH2 + NaOBr → RNH2
Якщо вдається довести, що виділений інтермедіат дає той же продукт в умовах реакції з тією ж швидкістю, це служить вагомим доказом на користь передбачення про участь цієї сполуки в реакції в якості інтермедіата. Але цей факт не можна вважати остаточним, оскільки виділена сполука може утворюватися альтернативно або може випадково утворювати той же продукт.
2. Детектування інтермедіата фізичними методами. В багатьох випадках інтермедіат не вдається виділити, але вдається показати його присутність за допомогою ІЧ-, ЯМР- або інших спектрів.
3. Детектування інтермедіата хімічними методами. В деяких випадках, коли інтермедіат специфічно взаємодіє з певними реагентами, а вихідні сполуки і продукти реакції з ними не реагують, вдається зв’язати інтермедіат хімічно.
4. Введення в реакцію інтермедіата. Якщо можливий інтермедіат вдається отримати іншими методами, тоді при проведені реакції з ним в тих же умовах повинні отримуватися ті ж продукти реакції. Але даний спосіб не є однозначним.
Цінні дані про механізм реакції отримують при вивченні реакцій, які проходять зі зміною оптичної активності речовин. Так, утворення рацематів вказує на те, що реакція проходить через плоску структуру, для якої рівна ймовірність атаки з будь-якої зі сторін.
Важливим для вивчення механізму реакції є вивчення продуктів реакції, особливо у тих випадках, коли утворюються продукти, яких не очікували. Для перевірки правильності встановленого механізму реакції часто достатньо підтвердити, що зміна швидкості реакції проходить згідно розрахунків при зміні концентрації реагентів або умов реакції. Дослідження органічних реакцій і їх систематизація дозволяє узагальнити багаточисельні реакції і звести їх вивчення до обмеженого числа механізмів реакцій.
Читайте також:
- Агроекологічні проблеми розвитку і шляхи їх розв'язання
- Адаптовані й специфічні методи дослідження у журналістикознавстві
- Адвокатура — неодмінний складовий елемент механізму забезпечення прав людини.
- Адміністративно-правові методи забезпечення економічного механізму управління охороною довкілля
- Актуальність дослідження
- Алгоритм дослідження кон’юктури
- Альтернативні шляхи охорони атмосфери
- Альтернативні шляхи охорони атмосфери
- Альтернативні шляхи охорони атмосфери
- Аналіз документів як метод соціологічного дослідження.
- Аналіз інформації та постановка задачі дослідження
- Аналіз потреб споживачів та аналіз конкурентів у процесі маркетингового дослідження
| <== попередня сторінка | | | наступна сторінка ==> |
| ЕНЕРГЕТИКА І КІНЕТИКА РЕАКЦІЙ. | | | НУКЛЕОФІЛЬНЕ ЗАМІЩЕННЯ В АЛІФАТИЧНОМУ РЯДІ. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |