
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Класифікація окисно-відновних реакцій
1. Міжмолекулярні окисно-відновні реакції. Окисник і відновник знаходяться в різних речовинах; обмін електронами в цих реакціях відбувається між різними атомами чи молекулами:
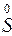 +
+  ®
® 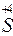
 ;
; 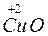 +
+ 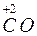 ®
® 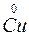 +
+  .
.
S – відновник; O2 – окисник CO – відновник; Cu – окисник
 + 2HCl ®
+ 2HCl ® 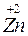 Cl2 +
Cl2 + 
Zn – відновник; HСl – окисник
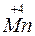 O2 +
O2 + 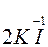 + 2H2SO4 ®
+ 2H2SO4 ®  + K2SO4 +
+ K2SO4 +  SO4 + 2H2O.
SO4 + 2H2O.
KI – відновник; MnO2 – окисник.
Сюди ж відносяться реакції між речовинами, у яких атоми того самого елемента мають різні ступені окиснення:
2H2 + H2
+ H2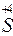 O3 ® 3
O3 ® 3 + 3H2O.
+ 3H2O.
2. Внутрімолекулярні окисно-відновні реакції. У внутрімолекулярних реакціях окисник і відновник знаходяться в одній і тій же молекулі. Внутрімолекулярні реакції протікають, як правило, при термічному розкладі речовин, що містять окисник і відновник.
2K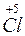 O3–2 –t°® 2K
O3–2 –t°® 2K + 3
+ 3 ;
; 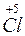 – окисник;
– окисник;  – відновник.
– відновник.
 H4
H4 O3 –t°®
O3 –t°® 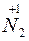 O + 2H2O;
O + 2H2O;  – окисник;
– окисник;  – відновник.
– відновник.
2Pb( O3–2)2–t°® 2PbO + 4
O3–2)2–t°® 2PbO + 4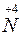 O2 +
O2 +  ;
; 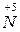 – окисник;
– окисник; 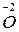 – відновник.
– відновник.
3. Диспропорціонуванння– окисно-відновна реакція, у якій один елемент одночасно підвищує і знижує ступінь окиснення.
 + 2KOH ® K
+ 2KOH ® K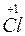 O + K
O + K + H2O;
+ H2O;
3K2 O4 + 2H2O ® 2K
O4 + 2H2O ® 2K O4 +
O4 + 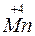 O2 + 4KOH;
O2 + 4KOH;
2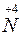 O2 + 2KOH ® K
O2 + 2KOH ® K O3 + K
O3 + K O2 + H2O.
O2 + H2O.
Визначити можливість перебігу окисно-відновних реакцій і їх напрямок можна на основі окисно-відновних потенціалів. Умовою здійснення таких реакцій є позитивне значення електрорушійної сили.
Питання та завдання для самоконтролю
1. Які реакції називаються окисно-відновними?
2. Вкажіть типи окисно-відновних реакцій.
3. Які речовини в окисно-відновних реакціях називаються відновниками, а які – окисниками?
4. Визначте ступінь окиснення Сr в наступних сполуках: К2СrО4, Сr2О3, Fе(СrО2)2, К2Сr2О7, Сr2(SО4)3.
5. Вкажіть, які з приведених процесів являють собою окиснення, а які – відновлення: S → SO ; S → S
; S → S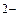 ; Sn → Sn
; Sn → Sn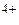 ; К → К+; Вr2 → 2Вr
; К → К+; Вr2 → 2Вr ; 2Н+ → Н2; Н2 → 2Н–; СI– → СIО
; 2Н+ → Н2; Н2 → 2Н–; СI– → СIО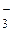 ; V2+ → VO3–; IО
; V2+ → VO3–; IО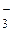 → I2 ; МnО
→ I2 ; МnО → МnО
→ МnО .
.
6. Дорівняйте реакції методом електронного балансу. До якого типу окисно-відновних реакцій відносяться рівняння?
а) КМnО4 + КОН → К2МnО4 + О2 + Н2О;
б) NН4NО2 → N2 + Н2О;
в) NаОН + S → Nа2S + Nа2SО3 + Н2О;
г) Р + КОН + Н2О → РН3 + КН2РО2;
д) Н2О2 → О2 + Н2О;
є) КМnО4 + МnSО4 + Н2О → МnО2 + К2SО4 + Н2SО4;
е) Zn + HNO3 → Zn(NO3)2 + N2O + H2O;
ж) NH4NO3 → N2O + H2O;
з) H2S + HNO3 → S + NO2 + H2O;
і) Аg + HNO3 → AgNO3 + NO2 + H2O.
7. Закінчіть і зрівняйте рівняння реакцій, вкажіть окисник і відновник:
а) Мn(ОН)2 + Сl2 + КОН → МnО2 + ...
б) МnО2 + О2 + КОН → К2МnО4 + ...
в) РbS + НNО3 → РbSО4 + NО2 + ...
г) КМnО4 + FeSО4 + Н2SО4 →
д) К2Cr2О7 + НCl →
е) Н2S + К2Cr2О7+ Н2SО4 →.
Розділ 2. Електрохімічні процеси
2.1. Поняття та визначення. Електродний потенціал
Електрохімія – розділ хімії, в якому вивчають закономірності взаємного перетворення електричної та хімічної енергії. Подібні перетворення здійснюються в електрохімічних системах, складовими системами яких є:
1) електроліт, який забезпечує проходження електричного струму (провідник другого роду) й містить речовини, здатні окиснюватися або відновлюватись на електродах;
2) електроди, що забезпечують контакт з електролітом та обмін електронами з учасниками реакції;
3) зовнішній ланцюг (провідник першого роду) – металічний провідник, який сполучає електроди.
Електрохімічні реакції є окисно-відновними гетерогенними реакціями, які перебігають на електродах, тобто на межі поділу двох фаз.
При зануренні металічної пластинки у воду під впливом її полярних молекул катіони металу переходять до рідкої фази. На межі „метал – розчин” швидко встановлюється рухома окисно-відновна рівновага:
Ме + nH2O ⇄ Me(H2O)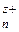 + n
+ n
або спрощено
Ме ⇄ Me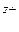 + n
+ n .
.
На поверхні металічної пластинки виникає подвійний електричний шар. Різницю потенціалів, яка виникає між металом та водним середовищем у стані рівноваги, називають рівноважним електродним потенціалом або потенціалом електрода.
При зануренні металу у розчин його солі також виникає подвійний електричний шар, але в цьому випадку можливі два механізми його утворення. Якщо концентрація катіонів металу в розчині не досягає рівноважної або метал досить активний, то рівновага процесу окиснення металу зміщується праворуч, металічна пластинка заряджується негативно. Якщо концентрація катіонів металу в розчині перевищує рівноважну або метал малоактивний, то рівновага зміщується ліворуч, металічна пластинка заряджуєтьмя позитивно.
Різниця потенціалів, яка виникає між металом та розчином є електродним потенціалом – j. Потенціал металу в розчині його солі записують як 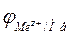 (
( – окиснена форма металу,
– окиснена форма металу, 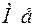 – відновлена форма металу, риска – поверхня розділу „розчин-метал”). Потенціалу приписують той знак, який виникає на металі в подвійному електричному шарі.
– відновлена форма металу, риска – поверхня розділу „розчин-метал”). Потенціалу приписують той знак, який виникає на металі в подвійному електричному шарі.
Величина електродного потенціалу для металічних електродів залежить від природи металу, концентрації його йонів у розчині електроліту та температури і обчислюється за рівнянням Нернста:
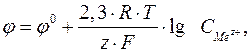
де j0 – стандартний електродний потенціал (потенціал, який виміряно за стандартних умов:  = 1 моль/л, р = 101,325 кПа, Т = 298 К); R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F = 96500 Кл/моль, стала Фарадея;
= 1 моль/л, р = 101,325 кПа, Т = 298 К); R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F = 96500 Кл/моль, стала Фарадея;  – концентрація йонів металу в розчині, моль/л.
– концентрація йонів металу в розчині, моль/л.
При Т = 298 К рівняння Нернста має вигляд:
 .
.
Абсолютне значення потенціалу окремого електрода виміряти неможливо, оскільки він реалізується в різних фазах. Його вимірюють відносно величини потенціалу іншого електрода. Такі електроди називають електродами порівняння. Найчастіше для цієї мети використовують стандартний водневий електрод, для якого потенціал умовно приймають за  В.
В.
Більшість стандартних електродних потенціалів визначають експериментально. Але для лужних та лужно-земельних металів j0 обчислюють лише теоретично. Це пояснюється тим, що дані метали взаємодіють з водою.
Значення стандартних електродних потенціалів металів, що розміщені у порядку їх зростання утворюють ряд, який називають рядом стандартних електродних потенціалів або електрохімічним рядом напруг (додаток 8). Стандартний електродний потенціал є мірою хімічної активності металу. Положення того чи іншого металу у ряді напруг характеризує відновну здатність металів та окиснювальну здатність їх йонів у водних розчинах. Чим менше алгебраїчна величина потенціалу, тим вище відновна здатність цього металу.
2.2. Хімічні джерела електричної енергії
2.2.1. Гальванічні елементи
Спеціальні пристрої, в яких на електродах відбуваються cамодовільні окисно-відновні процеси і які створюють різницю потенціалів, а отже можливість напрямленого переміщення електронів від одного електрода (негативного) до другого (позитивного), тобто електричний струм, називають хімічними джерелами струму (ХДС). При цьому хімічна енергія окисно-відновної реакції перетворюється на електричну. До таких пристроїв відносять гальванічні та паливні елементи, акумулятори.
Гальванічний елемент складається із двох електродів – анода і катода, занурених у розчин або розплав електроліту, електролітичного ключа (сольовий місток) і зовнішньої схеми (металічні провідники та вимірювач напруги чи сили струму).
У гальванічних елементах окисно-відновні реакції протікають на поверхні електродів. Процеси окиснення і відновлення просторово розділені. Окиснення протікає на аноді, відновлення – на катоді. У гальванічному елементі анодом є електрод, ОЬЮпотенціал якого менший, ніж потенціал катода. Анод має заряд "–", катод – заряд "+".
Максимальну напругу гальванічного елемента, яка відповідає оборотному процесу окисно – відновної реакції на його електродах, називають електрорушійною силою – Е (ЕРС) елемента. Якщо реакція здійснюється за стандартних умов, тобто якщо всі речовини, які беруть участь у реакції, перебувають у своїх стандартних станах, то ЕРС, що досягається називають стандартною ЕРС цього елемента. ЕРС гальванічного елементу обчислюють як різницю між потенціалами катода jк і анода jа.: Е = jк – jа.
Прикладом гальванічного елемента є мідно-цинковий елемент Даніеля-Якобі, що складається з цинкової та мідної пластинок, занурених в розчини сульфатів цинку та купруму (ІІ) з молярними концентраціями 1 моль/л (рис. 1).
Цинковий електрод є анодом, на якому проходить реакція окиснення: Zn = Zn2+ + 2ē.
= Zn2+ + 2ē.
Мідний електрод – катод, на якому проходить відновлення йонів міді з розчину: Cu2+ + 2ē = Cuo
Сумарне рівняння процесу в йонному вигляді:
Zn + Cu2+ = Cuo + Zn2+,
+ Cu2+ = Cuo + Zn2+,
або в молекулярній формі: Zn + CuSO4 = Cu + ZnSO4.
Схематичний запис гальванічного елемента:
(–) Zn| ZnSO4 || CuSO4| Cu (+).
За стандартних умов ЕРС гальванічного елемента (додаток 1):
 .
.
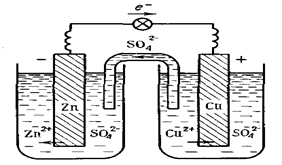
Рис. 1. Схема гальванічного елемента Даніеля-Якобі
Поляризація – це зміна величини електродного потенціалу катода чи анода через зміну стану поверхні електрода – утворення нерозчинних солей, оксидних і газових плівок, які виникають на поверхні електрода при роботі гальванічного елемента. Наприклад, для гальванічного елементу: Zn | H2SO4 | Cu на катоді відбувається процес: 2H+ + 2ē → H2↑.
Хімічна поляризація в цьому випадку обумовлена утворенням газової плівки водню, що ізолює поверхню катода від розчину електроліту, в наслідок чого зменшується ЕРС.
Концентраційна поляризація електродіввиникає за рахунок зміни концентрації йонів у приповерхневому шарі електрода, що впливає на величину потенціалу електрода. Наприклад, при роботі мідно-цинкового гальванічного елемента:
Zn │ZnSO4 ║СuSO4 │ Cu
зростає концентрація йонів Zn2+ біля анода і зменшується концентрація йонів Сu2+ біля катода, це призводить до зближення потенціалів катода і анода, тобто до зменшення ЕРС. Усунення або зниження поляризації називається деполяризацією. Концентраційна поляризація зменшується за рахунок перемішуванням електроліту, а хімічна – введенням деполяризаторів.
2.2.2. Акумулятори
Гальванічні елементи оборотної та багаторазової дії називають акумуляторами. Дані пристрої здатні при розряджанні перетворювати накопичену хімічну енергію на електричну (як гальванічний елемент), а при заряджанні електричну – на хімічну (як електролізер). Найбільше застосування мають свинцевий (кислотний) та лужні акумулятори. Свинцевий акумулятор складається з свинцево-стибієвих перфорованих пластинок. Отвори пластинок заповнюють пастою PbO i 2PbO · PbO2. Електроліт – розчин з масовою часткою сульфатної кислоти 35 %. Розглянемо принцип дії свинцевого акумулятора, схему якого можна записати так:
А (–) Рb|Н2SO4|PbO2 (+) K.
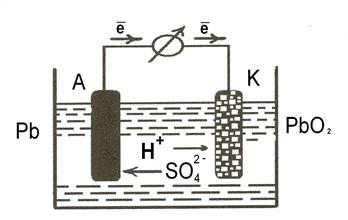
Рис.2. Схема роботи свинцевого акумулятора при заряджанні та розряджанні
Під час заряджання, коли через акумулятор пропускають постійний електричний струм, на електродах відбуваються такі електрохімічні процеси:
На катоді (–): PbSO4 + 2е→ Pb + SO42–.
На аноді (+): PbSO4 + 2Н2О → РbО2 + 4Н+ + SO42– + 2е.
Під час розряджання акумулятора на електродах відбуваються протилежні процеси:
На аноді (–): Pb + SO → PbSO4 +2е; φ° = 0,36 В.
→ PbSO4 +2е; φ° = 0,36 В.
На катоді (+): РЬО2 + 4Н+ + SO + 2е → PbSO4 + 2Н2О; φ°= 1,68 В.
+ 2е → PbSO4 + 2Н2О; φ°= 1,68 В.
Загальне рівняння реакції роботи свинцевого акумулятора має вигляд: Pb + 2H2SO4 + РbO2  2PbSO4 + 2H2O.
2PbSO4 + 2H2O.
Pb + 2H2SO4 + РbO2  2PbSO4 + 2H2O
2PbSO4 + 2H2O
ЕРС акумулятора E° = φ°к – φ°а = 1,68 – (– 0,36) = 2,04 В.
Різниця потенціалів зарядженого акумулятора дорівнює 2,04 В; якщо вона знижується до 1,7 В, то це свідчить, що акумулятор треба заряджати. Під час експлуатації (роботи, розрядження) акумулятора густина електроліту (розчину Н2SO4) знижується, тоді як під час зарядження його, навпаки, – зростає.
Перевагами свинцевих акумуляторів є: стабільність у роботі, великі електрична ємність, кількість циклів розрядження – зарядження та термін зберігання (до 2 років), а недоліками – великі маса і розміри, отже мала питома ємність, виділення водню під час розрідження та негерметичність у процесі використання агресивного електроліту. Дещо кращими є лужні акумулятори, наприклад нікель-кадмієві, нікель-залізні, срібно-цинкові тощо.
В нікель-залізному акумуляторі отвори залізних пластинок заповнені Ni2O3 × H2O (або Ni(OH)3) у суміші з порошком графіту та порошком відновленого заліза. Заряджання й розряджання лужного нікель-залізного акумулятора відбувається за схемою:
Fe + 2Ni(OH)3  Fe(OH)2 + 2Ni(OH)2;
Fe(OH)2 + 2Ni(OH)2;
Fe + 2Ni(OH)3  Fe(OH)2 + 2Ni(OH)2.
Fe(OH)2 + 2Ni(OH)2.
Напруга цього акумулятора при його розряджанні становить близько 1,3 В.
2.2.3. Паливні елементи
В паливних елементах електричний струм виникає в результаті хімічної взаємодії горючих речовин з окисниками, які безперервно подаються ззовні до електродів, а продукти реакції безперервно відводяться. Роль активних матеріалів негативного електрода (анода) відіграють звичайні види палива (горючі речовини): водень, бензин, природний газ, карбон(ІІ) оксид, кокс, метанол тощо). Активним матеріалом катода паливного елемента може бути: кисень повітря, або чистий кисень, хлор.
Прикладом може бути воднево-кисневий елемент, який складається з дрібнопористих вугільних або нікелевих електродів, занурених у лужний розчин електроліту:
А (–) (Ni) H2 | KOH |O2 (Ni) (+) K
А: 2Н2 + 4ОН– = 4Н2О + 4 .
.
К: О2 + 2Н2О + 4 = 4OH– .
= 4OH– .
Водень дифундує крізь пористий електрод з каталізаторами (Pt, Pd), кисень – крізь другий електрод зі змішаними каталізаторами (Co і Аl або Fe, Mn і Ag). Воднево-кисневі елементи генерують струм 500-700 мА на 1 см2 активної поверхні електродів при напрузі близько 1 В та ККД 60 – 70 %.
Питання та завдання для самоконтролю
1. Що називається гальванічним елементом?
2. За яким принципом записують схему гальванічного елемента?
3. Що називається стандартним електродним потенціалом?
4. Як обчислити електродний потенціал металевого електроду?
5. Який електрод у гальванічному елементі є анодом і які реакції на ньому протікають?
6. Який електрод у гальванічному елементі є катодом і які реакції на ньому протікають?
7. Як обчислити електрорушійні силу (ЕРС) гальванічного елемента?
8. Як за схемою гальванічного елемента написати рівняння реакції? Наведіть приклади.
9. Складіть схеми двох гальванічних елементів, в одному з яких мідь служила би катодом, а в іншому – анодом. Напишіть рівняння реакцій, що відбуваються при роботі цих елементів, і обчисліть значення ЕРС.
10. Обчисліть електродні потенціали магнію в розчині його солі при концентраціях йона Мg2+ 0,1; 0,01 і 0,001 моль/л.
11. а) З вказаних металів запропонуйте гальванічний елемент з максимальною ЕРС;
б) запишіть процеси, які відбуваються на електродах; в) обчисліть значення ЕРС за стандартних умов;
г) обчисліть значення ЕРС при умові, якщо анод занурений у розчин з молярною концентрацією солі 0,01 моль/л, а катод – у розчин з молярною концентрацією солі 0,001 моль/л.
| № | Метали | № | Метали | № | Метали | № | Метали |
| Al, Pb, Co | Pb, Pd, Sn | Ag, Mn, Fe | Al, Fe,Ti | ||||
| Ag, Pb, Sn | Co, Ca, Pt | Mo, Mn, Cu | Mn, Cd, Ni | ||||
| Hg, Mn, Fe | Bi, Cr,Cu | Ni, Pb, Pt | Fe, Zn, Sb | ||||
| Zn, Fe, Ni | Cd, Co, Cu, | Bi, Ag, Sn | Bi, Mn, Ag | ||||
| Cu, Pb, Pt | V, Tl, Ag | Co, Cu, Au | Co, Cd, Al |
При визначенні ЕРС користуйтесь додатком 1.
Додаток 1
Стандартні електродні потенціали металів у водних розчинах
| Електродна пара | φ0, В | Електродна пара | φ0, В | Електродна пара | φ0, В |
| Li+/Li | –3,045 | Ti2+/Ti | –1,630 | Sn2+/Sn | –0,136 |
| Rb+/Rb | –2,925 | Ti3+/Ti | –1,208 | Pb2+/Pb | –0,126 |
| K+/K | –2,924 | Mn2+/Mn | –1,192 | Fe3+/Fe | –0,037 |
| Cs+/Cs | –2,923 | V2+/V | –1,175 | 2H+/H2 | 0,000 |
| Ra2+/Ra | –2,916 | Nb3+/Nb | –1,100 | Sb3+/Sb | +0,240 |
| Ba2+/Ba | –2,905 | Cr2+/Cr | –0,852 | Bi3+/Bi | +0,317 |
| Sr2+/Sr | –2,888 | Zn2+/Zn | –0,763 | Co3+/Co | +0,330 |
| Ca2+/Ca | –2,864 | Cr3+/Cr | –0,744 | Cu2+/Cu | +0,345 |
| Na+/Na | –2,711 | Ga3+/Ga | –0,560 | Cu+/Cu | +0,520 |
| Ac3+/Ac | –2,600 | Fe2+/Fe | –0,440 | Hg22+/2Hg | +0,850 |
| La3+/La | –2,522 | Cd2+/Cd | –0,403 | Ag+/Ag | +0,799 |
| Ce3+/Ce | –2,483 | In3+/In | –0,338 | Pb4+/Pb | +0,840 |
| Y3+/Y | –2,372 | Ti3+/Ti | –0,368 | Hg2+/Hg | +0,852 |
| Mg2+/Mg | –2,363 | Tl+/Tl | –0,336 | Pd2+/Pd | +0,915 |
| Be2+/Be | –1,847 | Co2+/Co | –0,277 | Pt2+/Pt | +0,963 |
| U3+/U | –1,798 | Ni2+/Ni | –0,234 | Au3+/Au | +1,498 |
| Al3+/Al | –1,663 | Mo3+/Mo | –0,200 | Au+/Au | +1,691 |
Розділ 3. Електроліз
Електроліз – сукупність окисно-відновних процесів, що протікають на поверхні електродів при проходженні постійного електричного струму через розплав чи розчин електроліту.
Пристрої, в яких електричний струм від зовнішніх джерел витрачається для здійснення на електродах окисно-відновних реакцій, називають електролізерами, де відбуваються електролізні процеси. Електрод, на якому відбувається процес відновлення, називається катодом, а електрод на якому відбувається процес окиснення – анодом. Механізми процесів відновлення і окиснення залежать від хімічного характеру електроліту, його стану, природи електродів та інших факторів. Тому необхідно розглядати окремо процеси електролізу розплавів і розчинів, а також процеси електролізу з інертним і активним (металевим) анодами.
Інертні аноди виготовляють із платини, іридію або їх сплавів, а також із графіту або вугілля. У процесі електролізу вони не розчиняються.
При електролізі розплавів на катоді відновлюються катіони, а на аноді окиснюються аніони електроліту. Наприклад:
1) Електроліз розплаву натрій хлориду. При проходженні електричного струму крізь розплав натрій хлориду катіони натрію під дією електричного поля пересуваються до негативного електрода (катода), де відбувається їх відновлення. Аніони хлору пересуваються до позитивного електрода (анода), де віддають електрони, тобто окиснюються – це перша стадія. На другій стадії – утворюється молекула хлору з атомів. Схема електролізу має вигляд:



 NaCl ⇄ Na+ + Cl–
NaCl ⇄ Na+ + Cl–
(–) Катод Анод (+)
Na+ + ē = Na 2Cl– = 2Cl + 2ē
2Cl = Cl2 .
Сумарне рівняння окисно-відновної реакції, яка проходить при електролізі розплаву натрій хлориду має вигляд: 2Na+ + 2Cl– = 2Na + Cl2.
2) Схема електролізу розплаву кальцій гідроксиду:



 Сa(ОН)2 ⇄ Сa2+ + 2ОН–
Сa(ОН)2 ⇄ Сa2+ + 2ОН–
(–) Катод Анод (+)
Сa2+ + 2ē = Сa 4ОН– = 2Н2О + О2 + 4ē.
При електролізі водних розчинів на катоді відбувається відновлення окисників у порядку зменшення їх електродних потенціалів.
При електролізі водних розчинів потрібно враховувати величину потенціалу процесу відновлення йонів Гідрогену. Цей потенціал залежить від концентрації йонів Гідрогену, і у випадку нейтральних розчинів (рН=7) 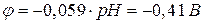 .
.
Таким чином, на катоді можливі три випадки:
1. Відновлення в першу чергу окисників, у яких електродні потенціали вищі, ніж потенціал водневого електрода. Це катіони Au+, Ag+, Cu2+, платинових металів. Відновлення відбувається за схемою:
Mez+ + zē = Me.
Наприклад при електролізі водного розчину купрум(ІІ) хлориду на катоді відбувається відновлення йонів Cu2+: Cu2+ + 2ē = Cu;
2. Відновлення катіонів металів, потенціал яких нижчий, ніж у водневого електрода (починаючи приблизно від Станума), але виший, ніж у титанового (метали середньої части ряду напруг: Zn, Cr, Fe, Cd, Ni). З урахуванням концентрації розчину і умов електролізу (густини струму, температури, складу розчину) можливе одночасне відновлення з катіонами металів і йонів Гідрогену (в кислому середовищі): 2Н+ + 2ē = Н2↑
або відновлення молекул води (в нейтральному і лужному середовищі):
2Н2О + 2ē = Н2↑ + 2ОН–.
Наприклад, при електролізі водного розчину цинк сульфату на катоді відбувається і відновлення йонів Zn2+: Zn2+ + 2ē = Zn;
і відновлення молекул води: 2Н2О + 2ē = Н2↑ + 2ОН–.
3. Відновлення молекул води, якщо водний розчин солей містить катіони металів, у яких потенціали нижчі, ніж у титану:
2Н2О + 2ē = 2ОН– + Н2↑.
Наприклад, при електролізі водного розчину калій сульфату на катоді відбувається відновлення молекул води.
Характер реакцій на аноді залежить від присутності води, pH середовища і матеріалу анода. У водних розчинах електролітів на інертному аноді спочатку окиснюються найбільш сильні відновники, тобто речовини з найменшим електродним потенціалом, наприклад, сульфід-йон, галогенід-йони та ін. Потім у лужному середовищі окиснюються гідроксид-йони:
4ОН– = О2↑ + 2Н2О + 4ē  = 0,401 В;
= 0,401 В;
у кислому або нейтральному середовищі окиснюються молекули води, якщо в розчині є оксигеновмісні аніони SO42–, NO3–, ClO3–, PO43–:
2H2O = O2↑ + 4H+ + 4ē  = 1,228 B.
= 1,228 B.
Послідовність окиснення аніонів і молекул на інертному аноді можна показати у вигляді такого ряду:
| S2–, I–, Br–, Cl–, OH–, H2O | SO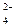 , NO , NO , ClO , ClO , PO , PO
|
| у водних розчинах не окиснюються |
При проведенні електролізу з активним анодом матеріал аноду розчиняється: Me = Mez+ + zē.
Наприклад, при електролізі водного розчину нікол (ІІ) сульфату з нікелевим анодом на катоді відбувається головним чином разряд йонів Ni2+ і виділення металу, а на аноді – окиснення металу (розчинення), так як потенціал ніколу менше потенціалу окиснення води і потенціалу окиснення йону SO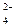 .
.



 Nі SO4 ⇄ Nі2+ + SO
Nі SO4 ⇄ Nі2+ + SO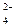
(–) Катод Анод (+)
Nі2+ + 2ē = Nі Nі = Nі2+ + 2ē.
Цей процес застосовується для електролітичної очистки нікелю (електролітичне рафінування).
Кількісно процеси електролізу визначаються законами Фарадея:
1) маса електроліту, що піддається перетворенню при електролізі, а також маси речовин, що виділяються на електродах, прямо пропорційні кількості електрики, що пройшла через розчин чи розплав електроліту:
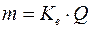 ,
,
де  – електрохімічний еквівалент, що дорівнює масі речовини, яка виділилася при протіканні одиниці кількості електрики (г/Кл);
– електрохімічний еквівалент, що дорівнює масі речовини, яка виділилася при протіканні одиниці кількості електрики (г/Кл);
2) при пропусканні однакової кількості електричного струму крізь розчини або розплави різних електролітів маси речовин, які виділилися на електродах, пропорційні їх молярним масам еквівалентів:
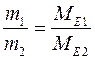 .
.
Обидва закони поєднують загальною формулою:
 ,
,  ,
,
де m, V – маса чи об’єм речовини, що зазнає перетворення на електродах (виділяється чи розкладається); ME – молярна маса еквівалентів речовини, г/моль;  – об’єм 1 моль еквівалента речовини; I – сила струму, А; t – час, с; F – стала Фарадея.
– об’єм 1 моль еквівалента речовини; I – сила струму, А; t – час, с; F – стала Фарадея.
Проведення процесу електролізу завжди викликає виникнення деякої різниці потенціалів, направленої протилежно тій, яка накладається зовні. Це явище одержало назву поляризація. Розрізняють хімічну і концентраційну поляризації.
Хімічна поляризація виникає внаслідок того, що виділення продуктів електролізу призводить до утворення гальванічного елемента. Наприклад, при електролізі розчину сульфатної кислоти водень і кисень, які виділяються відповідно на катоді і аноді, утворюють воднево-кисневий елемент, виникнення якого протидіє електролізу.
Концентраційна поляризація пов’язана з тим, що в процесі електролізу концентрації електроліту в катодному і анодному просторах змінюються і стають різними. Наприклад, при електролізі розчину нікелю з двома нікелевими електродами концентрація розчину в катодному просторі зменшується, а в анодному – збільшується. Виникає концентраційний елемент, ЕРС якого направлена протилежно накладеній різниці потенціалів.
Поляризація електродів збільшує витрату електричної енергії при електролізі, тому її намагаються якомога знизити.
Послабити концентраційну поляризацію можливо шляхом перемішування електроліту або обертанням електродів. Але цілком позбутися концентраційної поляризації не можна, тому що біля електрода завжди є дуже тонкий шар розчину, в якому рідина практично не перемішується. Щоб зменшити концентраційну поляризацію, електроліз проводять в насичених розчинах з надлишком твердої фази.
Для усунення хімічної поляризації необхідно повністю видаляти з електродів продукти електролізу, що призводять до виникнення елемента з протилежною ЕРС. З цією метою використовують хімічні деполяризатори. Так, для деполяризації катода застосовують окисники, які зв’язують водень, що виділяється на катоді (MnO2, K2Cr2O7 та ін.). Для деполяризації анода, навпаки, необхідні відновники, що зв’язують кисень (наприклад, етанол, який окиснюється на аноді до оцтової кислоти).
Мінімальна різниця потенціалів, яку треба створити, щоб електроліз відбувся, називається напругою розкладання Ер, а різниця між напругою розкладання і ЕРС (Е) утвореного гальванічного елемента називається перенапругою  U, тобто
U, тобто
 U = Ер – Е.
U = Ер – Е.
Величина перенапруги  U залежить від матеріалу електродів, концентрації електроліту тощо.
U залежить від матеріалу електродів, концентрації електроліту тощо.
Для врахування частини електрики, що пройшла через електроліт і витратилась на добування бажаного продукту введено поняття вихід за струмом. Вихід за струмом ŋ можна визначити як відношення маси речовини, добутої під час електролізу ( ), до кількості теоретично обчисленої за законом Фарадея (
), до кількості теоретично обчисленої за законом Фарадея (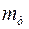 ):
):
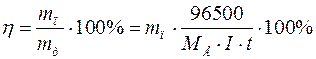 .
.
Або вихід за струмом визначається як співвідношення кількості електрики, необхідної за законом Фарадея для добування даної кількості речовини (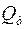 ), до кількості електрики, практично витраченої на добування тієї самої кількості речовини (
), до кількості електрики, практично витраченої на добування тієї самої кількості речовини ( ):
):
 .
.
Електроліз широко застосовується у металургійній та хімічній промисловості. Електролізом розплавів одержують лужні, лужноземельні метали та алюміній. Електролізом водних розчинів солей одержують цинк, кадмій, мідь та деякі інші метали. Електрохімічне рафінування металів використовують для одержання чистих металів (міді, олова, свинцю, срібла). Процеси електроосадження використовують для покриття поверхні одного металу іншим.
Гальваностегія – нанесення металевих покриттів з різною метою: захист від корозії, зміцнення поверхні, декоративне, антифрикційне, відновлення розмірів деталей (реставраційний ремонт), підвищення електропровідності та магнітних характеристик тощо. Найпоширенішими процесами є цинкування, нікелювання, міднення, хромування, кадміювання, лудження (покриття оловом). В гальваностегії катодом є виріб, який вкривають, а анодом – той самий метал, що осаджується на катоді.
Гальванопластика – виготовлення і розмноження копій деталей високої точності, відтворення макро- і мікрогеометричного рельєфу (матриці для грамплатівок, друкарські стереотипи, кліше, валки для тиснення шкір, тканин і фольги, копії з творів мистецтва тощо).
Електрохімічне оброблення металів – метод формоутворення виробів з металів будь-якої міцності й твердості, які важко піддаються механічному обробленню.
Електромеханічне шліфування і заточування інструментів.
Електроліз використовують для одержання ряду хімічних сполук: пероксиду гідрогену, калій перманганату, калій хлорату тощо.
Питання та завдання для самоконтролю
1. В чому полягає сутність процесу електролізу? Що таке вихід за струмом?
2. Яка принципова відмінність процесів, що відбуваються у гальванічному елементі та при електролізі?
3. Яке значення для електролізу має матеріал електрода?
4. Які реакції можливі на інертних та металевих електродах при електролізі?
5. Поясніть сутність процесів гальваностегії та гальванопластики?
6. Чому лужні метали не можна добути електролізом водних розчинів їхніх сполук?
7. Розчин містить йони Fe2+, Ag+, Bi3+ і Pb2+ в однаковій концентрації. У якій послідовності йони будуть виділятися при електролізі, якщо напруга достатня для виділення будь-якого металу?
8. При електролізі розчину солі металу (ІV) за 10 хвилин при силі струму 5 А виділилося на катоді 1,517 г металу. Визначте молярну масу еквівалентів металу та вкажіть його.
9. Обчисліть масу срібла, що виділилося на катоді при пропущенні струму силою 6 А через розчин аргентум нітрату протягом 30 хвилин.
10. При електролізі водного розчину хром (ІІІ) сульфату струмом силою 2 А маса катода збільшилася на 8 г. Протягом якого часу проводили електроліз?
11. Чому дорівнює молярна маса еквівалентів кадмію, якщо для виділення 1 г кадмію з розчину його солі треба пропустити через розчин 1717 Кл електрики.
12. При електролізі водного розчину станум (ІІ) хлориду на аноді виділилося 4,48 л хлору (н.у.). Знайти масу олова, яка виділилась на катоді.
13-30. Складіть схеми електролізу з інертними електродами водних розчинів солей:
| № | Речовини | № | Речовини |
| AgNO3, BaCl2 | КСl, Cu(NO3)2 | ||
| Cr(NO3)2, Na2S | NaNO3, CuI2 | ||
| CuI2, NaNO3 | КІ, Ni(NO3)2 | ||
| Na2SO4, CuCl2 | SnCl2, Fe2(SO4)3 | ||
| Hg(NO3)2, СаСl2 | СаСl2, Mn(NO3)2 | ||
| Ni(NO3)2, SnCl2 | CrCl3, CaSO4 | ||
| K2SO4, AuCl3 | К2S, SnSO4 | ||
| Na3PO4, СrСl3 | LiNO3, AuCl3 | ||
| KBr, HgSO4 | SnBr2, K3PO4 |
31-33. Якої сили повинен бути струм, щоб за час t шляхом електролізу з розчину солі виділився метал масою m г? Запишіть електродні процеси.
| № | Сіль | m, г | t |
| AgNO3 | 2,00 | 15 хв. 38 с. | |
| CuSO4 | 4,30 | 13 хв. 57 с. | |
| Fe2(SO4)3 | 2,50 | 20 хв. 46 с. |
Розділ 4. Корозія металів. Методи захисту від корозії
Корозія – це окисно-відновний процес руйнування металів у результаті їх фізико-хімічної взаємодії з навколишнім середовищем, який протікає самодовільно. Залежно від природи хімічних процесів, які лежать в основі руйнування металу, розрізняють такі типи корозії: хімічну, електрохімічну та електричну.
Хімічна корозія проходить у відсутності електроліту під дією навколишнього середовища, температури. Вона поділяється на газову, високотемпературну і корозію в неводних середовищах. Швидкість окиснення металу залежить як від швидкості власне хімічної реакції, так і від швидкості дифузії окисника через плівку сполук металів (оксидів, гідроксидів). Тому захисна дія плівки тим вища, чим краща її суцільність, і нижча дифузійна здатність. Суцільність та щільність плівки, що утворюється на металі, можна оцінити за співвідношенням об’єму оксиду чи іншої сполуки, що утворюється  , до об’єму, витраченого на утворення цих сполук металу
, до об’єму, витраченого на утворення цих сполук металу  . Це співвідношення називають фактором Піллінга-Бедвордса і позначають літерою
. Це співвідношення називають фактором Піллінга-Бедвордса і позначають літерою 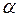 :
:
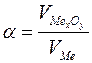 .
.
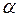 для різних металів наведено в таблице 4.1.
для різних металів наведено в таблице 4.1.
Таблица 4.1.
Значення фактора Піллінга-Бедвордса для деяких металів
| Метал | Оксид | 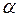
| Метал | Оксид | 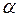
|
| Mg | MgO | 0,79 | Zn | ZnO | 1,58 |
| Pb | PbO | 1,15 | Zr | ZrO2 | 1,60 |
| Cd | CdO | 1,27 | Be | BeO | 1,67 |
| Al | Al2O3 | 1,31 | Cu | Cu2O | 1,67 |
| Sn | SnO2 | 1,33 | Cu | CuO | 1,74 |
| Nі | NiO | 1,52 | Ti | Ti2O3 | 1,76 |
| Nb | NbO | 1,57 | Cr | Cr2O3 | 2,02 |
Метали, що характеризуються значеннями 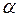 < 1, не можуть створювати суцільні та щільні оксидні плівки і, одже кисень, проникає через такі несуцільні шари (тріщини) до поверхні металу. Суцільні, щільні та стійки оксидні плівки утворюються за умови, коли
< 1, не можуть створювати суцільні та щільні оксидні плівки і, одже кисень, проникає через такі несуцільні шари (тріщини) до поверхні металу. Суцільні, щільні та стійки оксидні плівки утворюються за умови, коли 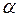 = 1,2-1,6. Однак і за більших значень
= 1,2-1,6. Однак і за більших значень 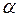 плівки іноді утворюються несуцільними та такими, що легко відділяються від поверхні металу, наприклад залізна окалина.
плівки іноді утворюються несуцільними та такими, що легко відділяються від поверхні металу, наприклад залізна окалина.
Якщо утворення оксидного шару за високою температурою супроводжується інтенсивною дифузією кисню в середину металу, то це призводить до зміни його складу внаслідок окиснення легуючих компонентів. Особливо це характерно для конструкційних сталей, у поверхневих шарах яких відбувається окиснення карбону й утворення феритної смуги, що супроводжується втратою міцності. Взаємодію сталей з окисними середовищами можна записати таким чином.
1) Під дією кисню повітря: 2Fe + O2 → 2 FeO,
FeO → [FeO],
[FeO] + [Fe3C] → 4 Fe + CO↑.
2) Під дією карбон (IV) оксиду: Fe + CO2 → FeO + CO,
FeO → [FeO],
Fe3C + CO2 → 3 Fe + 2CO↑.
3) Під дією пари води: Fe + H2O → FeO + H2,
FeO → [FeO], H2 → 2[H],
Fe3C + H2O → 3Fe + CO↑ + H2↑.
Третій випадок – найнебезпечніший, оскільки водень, розчиняючись у сталі створює підвищену крихкість металу.
Електрохімічна корозія – окисно-відновні процеси, які проходять у присутності електроліту і виникають внаслідок різниці електродних потенціалів між різними за активністю металами за рахунок виникнення великої кількості мікроскопічних гальванічних пар. Процес корозії супроводжується переміщенням електронів від більш активного металу (анод) до менш активного (катод) і призводить до руйнування більш активного металу. Електрохімічна корозія спостерігається також, коли на поверхні одного і того самого металу є ділянки, які відрізняються за своїми хімічними і фізичними властивостями. Залежно від середовища, в якому відбувається електрохімічна корозія, розрізняють атмосферну корозію, корозію в електролітах і ґрунтову корозію.
Розглянемо електрохімічну корозію на прикладі корозії заліза, якщо корозія відбувається в розчині кислоти (рН<7), то відбуваються такі реакції:
Анодний процес Fe0 = Fe2+ + 2ē
Катодний процес 2Н+ + 2ē = Н2
Fe0 + 2Н+ = Fe2+ + Н2.
Корозія заліза в нейтральному середовищі:
Анодний процес Fe0 = Fe2+ + 2ē
Катодний процес 2H2O + 2ē = Н2 + 2OH–
Fe + 2 H2O = Fe(OH)2 + Н2.
Атмосферна корозія заліза:
Анодний процес Fe0 = Fe2+ + 2ē
Катодний процес O2 + 2H2O + 4ē = 4OH–
2Fe + O2 + 2H2O = 2Fe(OH)2.
Ферум (ІІ) гідроксид, що утворюється, легко окиснюється киснем повітря: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Остання сполука частково відщеплює воду, при цьому утворюється речовина, яка за складом відповідає бурій іржі:
Fe(OH)3 → FeOOH + H2O.
Швидкість електрохімічної корозії ( )– найважливіша характеристика корозії, яка вимірюється одиницями маси (
)– найважливіша характеристика корозії, яка вимірюється одиницями маси ( ) втраченого металу з одиниці площі (
) втраченого металу з одиниці площі ( ) за одиницю часу (
) за одиницю часу ( ):
):
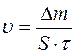 [мг/(м2·рік], [мг/(м2·год].
[мг/(м2·рік], [мг/(м2·год].
На швидкість корозії істотно впливають склад електроліту корозійного середовища і його температура. Зміна поверхні металу внаслідок корозійних процесів залежить від властивостей металу та умов їх перебігу.
Види корозійних пошкоджень визначають характером руйнування:
а) суцільна (рівномірна та нерівномірна), коли корозією пошкоджена приблизно в однаковій мірі вся поверхня металу чи сплаву;
б) місцева – пошкодження локальні – можуть бути у вигляді плям або глибоких поразок, які називають виразками або крапками. Місцева корозія пошкоджує лише незначну частину поверхні, процес корозії поширюється головним чином у глибину металу;
в) піттінг – пошкодження проникає всередину металу;
г) селективна корозія пошкоджує не чистий метал, а металічний сплав. У хімічну взаємодію у першу чергу вступає більш активний компонент такого сплаву;
д) інтеркристалітна (міжкристалітна) корозія характеризується руйнуванням металу за межами зерен і залежить від природи металу. Їй піддаються мідні сплави – латунь, бронза, а також деякі сталі.
є) транскристалітна корозія розсікає метал тріщиною крізь зерна.
Корозія металів завдає великої шкоди народному господарству. Це визначає важливість заходів, спрямованих на захист металів від корозії.
Захист металів від корозії
Залежно від способу захисту металів від корозії розрізняють такі методи захисту: підвищення хімічної стійкості металу (легування металів); ізоляція поверхні металу від агресивного середовища (нанесення металічних або неметалічних покриттів); зміна властивостей агресивного середовища; електрохімічний захист, хімічний захист.
Легування металів. Для поліпшення властивостей металів і забезпечення їхньої корозійної стійкості до складу сплавів вводять різні речовини (легуючі добавки). Корозійну стійкість сталі можна підвищити введенням хрому, нікелю, молібдену, вольфраму. Поверхневе легування – насичення поверхні сплаву металом чи неметалом, що утворює міцний оксидний шар (алітування, хромування, силіціювання тощо).
Металічні захисні покриття за характером поведінки їх під час корозії поділяють на катодні й анодні:
– якщо потенціал металу покриття більший, ніж потенціал основного (матричного) металу, то покриття називають катодним (наприклад, мідь, нікель, срібло відносно заліза);
– якщо потенціал металу покриття менший потенціалу основного (матричного) металу, то покриття називають анодним (наприклад, цинк, алюміній відносно заліза).
Неорганічні захисні покриття:
1) Оксидування металів – створення на поверхні металу щільного і міцного шару оксиду хімічним або електрохімічним способами.
2) Фосфатування металевої поверхні – процес осадження нерозчинних фосфатів цього металу на його поверхню.
Електрохімічні методи захисту. Суть методів полягає в тому, що металеву конструкцію, яку захищають від корозії, використовують, як катод. Розрізняють катодний і протекторний методи захисту. Катодний захист полягає в приєднанні об’єкта, який захищають (катода), до джерела постійного струму. Анодом можуть бути графіт або кусок заліза, які поступово кородують, захищаючи від корозії споруду. Протекторний захист: метал, що захищають, приводять у контакт з іншим металом, який має більш електронегативне значення електродного потенціалу. В утвореній гальванопарі приєднаний метал є анодом, який руйнується, а металева конструкція (катод) не кородує. Приєднаний анод є протектором.
Зміна корозійного середовища. Зменшення швидкості корозії досягають усуненням або зниженням концентрації агресивних реагентів у навколишньому середовищі, а також введенням речовин, які значно уповільнюють корозію – інгібіторів. Ці речовини гальмують швидкість корозії не змінюючи при цьому агресивних властивостей середовища. Дія інгібіторів полягає в тому, що на поверхні металу вони утворюють захисну плівку, яка ізолює метал від середовища або так змінює електродний потенціал металу, що активність його зменшується. Деякі інгібітори сприяють видаленню кисню (окисника) з робочого середовища, що також гальмує швидкість корозійного процесу. До неорганічних інгібіторів належать хромати, нітрати, фосфати та ін.
Питання та завдання для самоконтролю
1. Що називається корозією? Наведіть приклади руйнування металевих виробів внаслідок корозії.
2. Що таке інгібітор? Чим інгібітор відрізняється від каталізатора?
3. Чим визначається вибір захисту металу від корозії?
4. Які основні способи захисту металів від корозії ви знаєте? Наведіть приклади із власних спостережень.
5. Як впливає на корозію заліза його контакт з іншими металами? Який метал буде руйнуватися першим на ушкодженій поверхні лудженого, оцинкованого і нікельованого заліза?
6-15. Складіть схеми корозійних гальванічних елементів, що виникають внаслідок конструкційного контакту зазначених в умові металів у розчині з наведеним значенням рН: а) за наявності кисню, б) у відсутності кисню.
| № | Метали | рН | № | Метали | рН | № | Метали | рН |
| Mn; Cd | Mg; Co | Pb; Cd | ||||||
| Zn; Cd | Fe; Cd | Ag; Co | ||||||
| Mn; Ni | Mn; Co | |||||||
| Mn; Cd | Fe; Ni |
16-30. Назвіть метал, який можна використати: а) як анодне; б) як катодне покриття для захисту від корозії залізного виробу. Складіть схеми корозійних гальванічних елементів, які виникають під час атмосферної корозії внаслідок ушкодження кожного покриття та напишіть рівняння електродних процесів.
| № | Метали | № | Метали | № | Метали | № | Метали |
| Mn; Cd | Mg; Pb | Na; Pd | Al; Sn | ||||
| Zn; Cd | Ti (II); Bi | Ce; Pb | Al; Co | ||||
| Mn; Ni | Be; Ni | Zn; Hg | K; Mo | ||||
| Са; Cо | V; Cu | Nb; Pt |
Читайте також:
- II. Класифікація видатків та кредитування бюджету.
- V. Класифікація і внесення поправок
- V. Класифікація рахунків
- А. Структурно-функціональна класифікація нирок залежно від ступеню злиття окремих нирочок у компактний орган.
- Адміністративні провадження: поняття, класифікація, стадії
- Аналітичні процедури внутрішнього аудиту та їх класифікація.
- Банківська платіжна картка як засіб розрахунків. Класифікація платіжних карток
- Банківський кредит та його класифікація.
- Банківські ресурси, їх види та класифікація
- Будівельна класифікація ґрунтів
- Будівельні домкрати, їх призначення, класифікація та конструкція.
- Будівельні лебідки, їх призначення, класифікація та конструкція.
| <== попередня сторінка | | | наступна сторінка ==> |
| Розрахунок ступеня окиснення | | | ПОЛЯРИЗАЦІЯ ДІЕЛЕКТРИКІВ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |