
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Приклади розв’язання задач
Приклад 1. Обчислити дефект маси Δm і енергію зв'язку 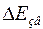 ядра
ядра 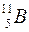 .
.
Розв’язання. Дефект маси ядра визначимо за формулою:
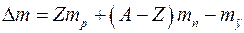 .
.
Підставимо в цю формулу  ,
, 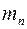 та
та 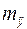 (
( 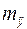 – табличне значення):
– табличне значення):
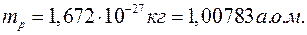 ;
;
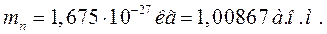 ;
;
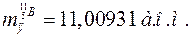 ,
,
одержимо:
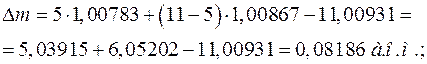

Енергія зв'язку ядра:
 ,
,
або
 .
.
Приклад 2. Енергія зв'язку 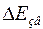 електрона з ядром незбудженого атома водню
електрона з ядром незбудженого атома водню  (енергія іонізації) дорівнює 13,6 еВ. Визначити, на скільки маса атома водню менша за суми мас вільних протона і електрона.
(енергія іонізації) дорівнює 13,6 еВ. Визначити, на скільки маса атома водню менша за суми мас вільних протона і електрона.
Розв’язання. Шукана величина є дефектом маси стійкої системи, що складається з протона і електрона, тобто дефект маси атома водню.
За законом пропорційності маси і енергії, маємо:
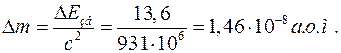
Визначення дефекту маси атома водню за формулою

в даний час неможливо, оскільки за своєю величиною (0,0000000149) він значно менший похибки сучасних методів вимірювання мас частинок.
У найбільш важких атомів енергія зв'язку електронної оболонки з ядром досягає десятих частин мегаелектрон-вольт, але оскільки енергія зв'язку нуклонів у важких ядрах близька до 1900 МеВ, то і в цьому випадку енергією зв'язку електронної оболонки з ядром можна знехтувати.
Приклад 3. Визначити енергію 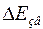 , яку потрібно витратити для відриву нейтрона від ядра
, яку потрібно витратити для відриву нейтрона від ядра  .
.
Розв’язання. Після відриву нейтрона число нуклонів А в ядрі зменшиться на одиницю, а число протонів Z залишиться незмінним; вийде ядро 22Na. Ядро 23Na можна розглядати як стійку систему, що утворилася в результаті захоплення вільного нейтрона ядром 22Na. Енергія відриву нейтрона від ядра 23Na дорівнює енергії зв'язку нейтрона з ядром 22Na.
Виразивши енергію зв'язку нейтрона через дефект маси системи, одержимо:
 .
.
При підстановці числових значень замінюємо маси ядер масами нейтральних атомів. Оскільки число електронів в оболонках атомів 22Na і 23Na однакове, різниця мас атомів 23Na і 22Na від такої заміни не зміниться:
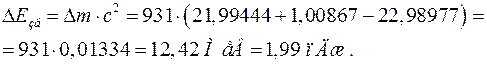
Читайте також:
- IV. Перевірка розв’язання і відповідь
- Алгоритм розв’язання задачі
- Алгоритм розв’язання розподільної задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі оптимізації в Excel
- АНАЛИЗ ЧУВСТВИТЕЛЬНОСТИ ОПТИМАЛЬНОГО РЕШЕНИЯ ОДНОИНДЕКСНЫХ ЗАДАЧ ЛП
- Аналіз задач і алгоритмів
| <== попередня сторінка | | | наступна сторінка ==> |
| Практичне заняття 3.1 | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |