
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Вимірювання хімічного складу рідин
Рідин
Тема 21. Вимірювання хімічного складу і концентрації
-Кондуктометричнийметоданалізу
Метод вимірювання електричної провідності розчинів
електролітів (кондуктометрія) широко застосовують в
лабораторній і виробничій практиці для хімічного аналізу і
автоматичного контролю ряду технологічних параметрів.
При розчиненні, електроліти дисоціюють на іони.
Степінь дисоціації á визначається відношенням числа
молекул n , що розпались на іони до загального числа молекул
N (іонізованих n і не іонізованих na)
á = / = / ( )
+ . (21.1)
n n na
Якщо á = 0 , то речовина не є електролітом. Якщо á → 1, то
речовина є сильним електролітом. Для слабких електролітів
0 < <á 1.
Здатність речовини проводити електричний струм
характеризується питомою електричною провідністю
[См см/ ] яка визначається як
÷0
÷0= 1/ ñ ÷ /
, (21.2)
де ñ - питомий електричний опір ( ñ = / ); ÷ - електрична
провідність речовини ( ÷ =1/ R , де R - електричний опір даної
речовини); l і s - відповідно дожина і площа поперечного
перерізу провідника.
Для
вимірювання
провідності
використовують
електролітичну вимірювальну комірку (рис. 21.1) яка являє
собою посудину заповнену аналізованим розчином, в якій
знаходиться мінімум два електроди.
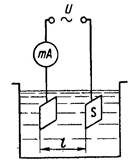
Рис. 21.1. Схема двоелектродної електричної комірки
В кондуктометрі відношення /l s , см−1 називається постіною
комірки k ( k l s/ еф).
В кондуктометрії часто оперують поняттям еквівалентної
електричної провідності l , яка зв’язана з питомою електричною
провідністю ÷0рівнянням
l ÷=0/ c або
l ÷=0V , (21.3)
де c - концентрація електроліту, (моль/мл); V - об’єм
електроліта (мл).
Наявність функціональної залежності
( )
÷ =0f c обумовлює
широке застосування методу кондуктометрії для визначення
концентрації електролітів.
В практиці вимірювання електричної провідності
застосовують в основному кондуктометричні прилади таких
типів: контактні з дво- і чотириелектродними комірками;
безконтактні низькочастотні з вимірювальною коміркою у
вигляді «рідинного витка» та безконтактні високочастотні з
вимірювальними комірками ємнісного та індуктивного типів.
-Контактнікондуктометричніприлади
Вимірювальна схема двоелектродної кондуктометричної
комірки (рис.21.2) містить: R1 , R2 , R3 - постійні манганінові
резистори; Rp - змінний компенсуючий резистор; Rx - опір
розчину кондуктометричної комірки.
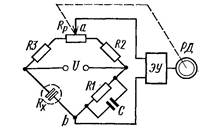
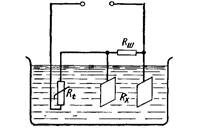
Рис. 21.2. Вимірювальна схема двоелектродної вимірювальної комірки
При зміні концентрації контрольованого розчину змінюється
опір Rxі в діагоналі ab мосту виникає різниця потенціалів.
Сигнал розбалансу пропорційний концентрації, підсилюється
електронним підсилювачем ЭУ і надходить до реверсивного
двигуна РД, який переміщує повзунок змінного резистора Rpта
зв’язану з ним стрілку показуючого пристрою, яка і показує
величину концентрації.
Для компенсації температурної похибки застосовують
автоматичні температурні компенсатори з використанням
терморезистивного перетворювача Rt (рис.21.3).
Рис. 21.3. Схема кондуктометричної комірки з терморезистивним
перетворювачем
Для температурної компенсації необхідно забезпечити
рівність температурних коефіцієнтів опору контрольованого
розчину Rxі терморезистора Rt. Для цього паралельно Rx
вмикають шунтуючий резистор Rш з низьким температурним
коефіцієнтом. У зв’язку з цим температурний коефіцієнт опору
 паралельного кола
паралельного кола
Rx− Rш знижується порівняно з
температурним коефіцієнтом розчину і наближається до
температурного коефіцієнта Rt, але з протилежним знаком.
Звідси, температурна компенсація зумовлена тим, що зі зміною
температури, зміна опору Rx− Rш компенсується опором Rt.
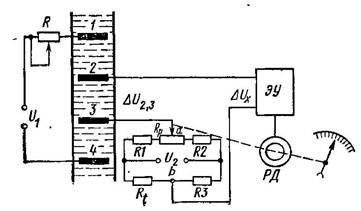
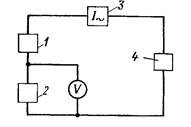
На рис. 21.4 наведено схему кондуктометра з
чотириелектродною вимірювальною коміркою.
Рис. 21.4. Схема кондуктометра з чотириелектродною вимірювальною
коміркою
Струм в розчині протікає між двома зовнішніми електродами
1 і 4, які увімкнені до джерела живлення напругою U1. Завдяки
великому опору резистора R , сила струму I в колі комірки є
постійною і не залежить від зміни опору розчину. Два внутрішні
електроди 2 і 3 виконують функції потенцометричних і
призначені для вимірювання спаду напруги
∆U2,3в розчині
де
/0
∆
U2,3
= IRя , (21.4)
Rя=k ÷ - опір розчину між електродами 2 і 3; k -
конструктивна константа чотириелектропровідної вимірної
комірки.
Отже
∆U
= kI
÷ = k′ ÷ , (21.5)
2,3
/
/
Де k′ = kI const .
З (21.5) різниця потенціалів між електродами 2 і 3 однозначно
визначається концентрацією контрольованого розчину.
Вимірювана величина
∆U2,3порівнюється з різницею
потенціалів Uabна вершинах a і b вимірювального мосту.
Якщо Uab≠ ∆U2,3, то на вхід підсилювача ЭУ надходить сигнал
розбалансу
∆Ux (
∆
Ux= Uab
− ∆U ), який після підсилення
2,3
надходить до реверсивного двигуна РД. Останній зумовлює
одночасне переміщення повзунка змінного резистора Rpі
повертання стрілки відносно шкали, яка показує величину
концентрації. Коли Uab= ∆U2,3, то струм в колі електродів 2 і 3
буде відсутнім
∆Ux= 0 і стрілка зупиниться.
Автоматичну компенсацію температури здійснюють за
допомогою терморезистора Rt, який увімкнено в одне з плечей
вимірювального мосту.
При зміні температури розчину, змінюється Rt, в результаті
чого Uabтакож змінюється. Приріст
повинно дорівнювати ∆Uab( )
∆Uab= f ( ) при зміні Rt
2,3( )
∆ = −∆U
. Ця рівність
досягається підбором опорів R1, R2і R3вимірювального мосту і
напругою U2.
-Безконтактнінизькочастотнікондуктометри
Особливістю таких приладів є відсутність гальванічного
контакту електродів вимірювальної комірки з аналізованим
середовищем (рис.21.5).
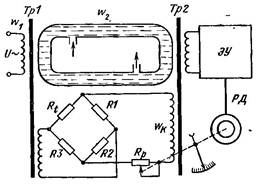
Рис. 21.5. Принципова схема низькочастотного кондуктометра з рідинним
контуром зв’язку
На схемі, трубка з діелектриком утворює замкнений виток,
який заповнено контрольованим розчином електроліту. Зовні, на
трубку намотано обмотки двох трансформаторів – збуджуючого
Tp1 і вимірювального Tp 2 . Первинна обмотка Tp1 під’єднана
до джерела змінного струму, напругою U . Замкнений виток з
електролітом виконує функцію вторинної обмотки
Tp1. В
результаті електромагнітної взаємодії в рідинному витку
наводиться ЕРС Ep
Ep=
Uw w1/2, (21.6)
де w1 - кількість витків первинної обмотки Tp1; w2 - рідинний
виток ( w2= 1); U - напруга живлення первинної обмотки 1 .
Сила струму Ip, який протікає в рідині під дією ЕРС
дорівнює
I = E R E ÷ k
= ÷ wU w k , (21.7)
p
p
/
p
/
p
/
p
де R - опір рідинного витка; kp - константа низькочастотної
комірки.
В (21.6) усі величини крім ÷ є постійними, тому Ip
пропорційний концентрації розчину.
Струм Ipвимірюється
Tp2 , у якого рідинний виток є
первинною обмоткою. ЕРС Enу вторинній обмотці пропорційна
концентрації.
то
Умова компенсації запишеться
/
I wKK=I wp2.Оскільки w2= 1 ,
IK= IpwK. Положення движка реохорда і стрілки приладу
пропорційна концентрації контрольованого розчину. Для
компенсації температурної похибки призначений терморезистор
Rt, який увімкнений в мостову коректуючу ланку
Rt− R1− R2− R3і знаходиться в контрольованому середовищі.
Безконтактні низькочастотні кондуктометри частотою до
1000 Гц застосовуються для вимірювання концентрації як
сильних електролітів ( HCl , H SO24,HNO3, луги) так і слабких.
Широко також застосовуються безконтактні високочастотні
кондуктометри.
-Потенціометричнийметоданалізу
Метод потенціометричного вимірювання концентрації іонів в
розчині грунтується на вимірюванні різниці електричних
потенціалів двох спеціальних електродів, які поміщені в
досліджуваний розчин гальванічної комірки, причому один
електрод – допоміжний в процесі вимірювання має постійний
потенціал.
Сигнал гальванічної комірки (різниця потенціалів), як
зазначалось, зв’язяний з величиною рН лінійно а сама ця
величина є мірою активної концентрації рідини.
За принципом дії рН-метри на основі потенціометричного
вимірювання концентрації іонів можна розділити на три основні
групи: прилади з безпосереднімвідліком, прилади з астатичною
компенсацією, прилади зі статичноюкомпенсацією.
Найпростіша принципова схема рН-метра з безпосереднім
відліком наведена на рис. 21.6.

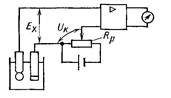
Рис. 21.6. Принципова схема рН-метра з безпосереднім відліком:
1, 2 – відповідно скляний і допоміжний електроди; 3 – операційний
підсилювач; 4 – вимірювальний прилад або цифроаналоговий перетворювач
ЕРС
Exвимірювальної комірки подається на вхід
підсилювача 3, який є операційним підсилювачем постійного
струму, охопленим від’ємним зворотнім зв’язком.
Операційні підсилювачі в схемах рН-метрів мають на вході
польові транзистори, що забезпечує необхідний вхідний опір
підсилювача при вхідній силі струму порядка 10−13
−10− А.
Прилади з безпосереднім відліком досить прості, однак за
точністю вони поступаються приладам компенсаційного типу.
Найпростіший рН-метр компенсаційноготипу наведено на
рис. 21.7.
Рис. 21.7. Принципова схема рН-метра з ручною компенсацією
вимірюваної ЕРС
В цьому приладі застосовують метод астатичної компенсації,
коли послідовно з ЕРС електродної системи увімкнено рівну їй
по величині і протилежну за знаком напругу компенсації UK,
яка знімається з компенсуючого резистора
Rpабо
лабораторного потенціометра. Змінюючи за переміщенням
движка реохорда напругу UK, досягають того, щоб вихідний
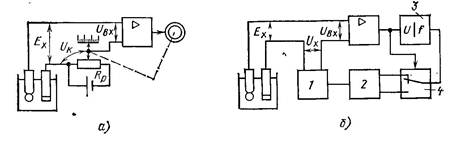 сигнал підсилювача був таким же, як і при нульовому сигналі на
сигнал підсилювача був таким же, як і при нульовому сигналі на
вході. При цьомуK
одиницях рН.
U = Ex. Шкала Rpпроградуйована в
Прилад, схема якого наведена на рис. 21.8,а відрізняється від
аналогічного рН-метра, що працює за методом «ручної
компенсації» тим, що движок реохорда будучи механічно
зв’язаним з показчиком шкали, приводиться в рух реверсивним
двигуном.
Рис. 21.8. Схема рН-метрів з автоматичною компенсацією вимірюваної
ЕРС
В момент компенсації (рис.21.8 а), коли Ex= UKнапруга на
вході Uвх підсилювача дорівнює нулю і реверсивний двигун а
значить і показчик зупиняється.
Недоліком таких приладів є складність кінематичної схеми
для привода движка реохорда.
Цей недолік відсутній у схемі рН-метра показаного на
рис.21.8,б.
Тут компенсаційна напруга створюється цифро-аналоговим
перетворювачем (ЦАП) 1, керованим реверсивним лічильником
U
= E − U ≠ , то
2. Якщо вхідна напруга підсилювача
вх
x K
підсилена напруга перетворюється в серію імпульсів частотою
f (в перетворювачі 3), які через перемикач 4 надходять,
залежно від полярності вихідної напруги підсилювача, до
сумуючого або віднімаючого входу реверсивного лічильника. В
момент компенсації, коли
Ex= UK
напруга на виході
підсилювача дорівнює нулю, імпульси на реверсивний
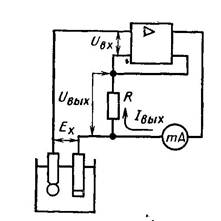 лічильник не надходять, а на виході ЦАП встановлюється
лічильник не надходять, а на виході ЦАП встановлюється
постійна напруга UK.
Поряд з приладами з астатичною компенсацією (повна
компенсація ЕРС), застосовують рН-метри зі статичною
(неповною компенсацією вимірювальної комірки).
Принципова схема такого рН-метра наведена на рис.21.9.
Рис. 21.9. Схема рН-метра зі статичною компенсацією
Тут вимірювана ЕРС Exпорівнюється з напругою Uвих,яка
утворюється від протікання вихідного струму Iвих підсилювача
по резистору R . На вхід підсилювача надходить різниця напруг
U = E −U . (21.8)
вх
x вих
Якщо повний коефіцієнт підсилення
k Uвих/Uвх,то (21.8)
перетворюється до виду Ex= Uвих(1 1/ )
k . При великому k
E ≈ U
= I R . (21.9)
x
вих вих
Отже сила струму, що протікає через останній каскад
підсилювача пропорційна вхідному сигналу від вимірювальної
комірки. Вимірявши Iвих,легко знайти Ex, тобто рН розчину.
 Тема 22. Полярографічний та кулонометричний методи
Тема 22. Полярографічний та кулонометричний методи
-Полярографічнийметод
Полярографічний метод було розроблено в 1922 році
чешським вченим Я.Габровським. Назву метод отримав у
відповідності з кривими силаструму –напруга, які також
називаються полярограмами.
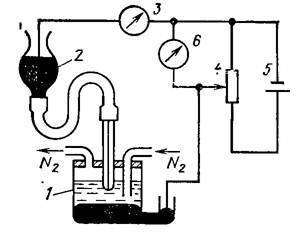
Найпростіша схема полярографа (рис.22.1) складається з
вимірювальної комірки, яка містить в собі електролізер 1, два
електроди і аналізований розчин, посудину 2 з ртуттю, з якої
вона по гнучкому шлангу подається у вимірювальний електрод
комірки, прилад для вимірювання сили струму 3, реостат 4,
джерело напруги 5 і прилад 6 для вимірювання напруги.
Рис. 22.1. Схема класичного полярографа
Джерело
напруги
забезпечує
зміну
потенціалу
вимірювального електроду в межах від +1 до -4 В.
Полярограма однокомпонентного розчину (рис.22.2)
складається з трьох характерних ділянок: І – залишкова сила
струму, ІІ – хвиля і ІІІ – гранична сила струму.
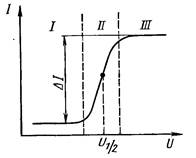
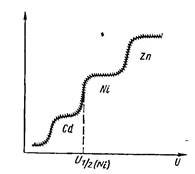
Рис. 22.2. Полярограма однокомпонентного розчину
Різниця граничної і залишкової сили струму ∆I , іншими
словами висотахвиліпропорційнаконцентраціїрозчину, а
напруга, яка відповідає середній точці хвилі U1/ 2 полярограми
характеризуєприродуречовини. Цю напругу називають
напругою півхвилі. Отже полярограма містить повну
інформацію про якість і кількість речовини в розчині. Якщо в
розчині є кілька речовин, то полярограма має вид, показаний на
рис. 22.3.
Рис. 22.3. Полярограма трикомпонентного розчину
Напруги півхвиль різних речовин наведено у відповідних
довідниках. Порівняння цих даних з експериментально
отриманими дозволяє встановити природу аналізованої
речовини.
Основними характеристиками полярографа є межа
визначення і роздільна здатність.
 Під межею визначення в полярографії розуміють мінімальну
Під межею визначення в полярографії розуміють мінімальну
концентрацію, яку прилад дозволяє визначити з заданою
точністю.
Під роздільною здатністю розуміють відношення
концентрацій супутнього (заважаючого) і аналізованого
компонентів.
Полярографи класифікують за зміною напруги на комірці в
часі: класичні, змінногоструму, імпульсні, високочастотні,
осцилографічні.
-Класичніполярографи
З допомогою полярографа, показаного на рис.22.1, можна
отримати полярограму класичного типу (рис.22.2). В класичній
полярографії на комірку накладається повільно змінна
поляризуюча напруга.
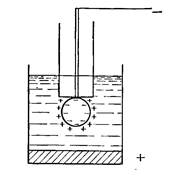
Розглянемо явища, що проходять на ртутно-крапельному
електроді.
Нехай до ртутного дна прикладено плюс джерела напруги а
до ртутної краплі – мінус. Розчином є електроліт, який містить в
собі іони аналізованої речовини (рис.22.4).
Рис. 22.4. Полярографічна комірка
В цьому випадку позитивно заряджені іони розчину підійдуть
до негативно зарядженої поверхні краплі і утворять прошарок
позитивно заряджених іонів навколо краплі. Цей подвійний
електричний шар можна розглядати як конденсатор, одною
обкладкою якого служить заряджена поверхня електрода, а
 другою – шар іонів, які знаходяться в приелектродній області.
другою – шар іонів, які знаходяться в приелектродній області.
Ртутно-крапельний електрод можна розглядати як конденсатор
зі змінною поверхнею. Тому, коли на комірку накладають
змінну напругу, по ній тече ємнісний струм Ic, який залежить
від змінного складу розчину.
Наявність залишкової сили труму пояснюється протіканням
через комірку ємнісного струму. Коли лінійно зростаюча
напруга дорівнюватиме напрузі, при якому аналізована
речовина починає відновлюватись на поверхні краплі, через
комірку протікає струм, пов’язаний з електрохімічною реакцією
на поверхні ртуті. В результаті розряду іонів аналізованої
речовини їх концентрація поблизу поверхні краплі зменшується,
яка поповнюється за рахунок дифузії іонів із маси розчину.
При напрузі
U U1/ 2 середнє значення струму Icp
дорівнюватиме половині граничного струму Id (
/ 2
Icp= Idcp).
Напруга півхвилі не залежить від концентрації аналізованої
речовини, а визначається, в основному, природою досліджуваної
речовини.
-Полярографизмінногоструму
Полярографам змінного струму притаманно ряд переваг,
зокрема зручність для дослідження кінетики електрохімічних
процесів та можливість застосування в якості аналізаторів
неперервної дії.
В полярографах змінного струму на комірку діє сумарна
напруга від двох джерел: джерела постійної поляризуючої
напруги і джерела змінної напруги (рис. 22.5).
Рис. 22.5. Принципова схема полярографа змінного струму:
1 і 2 – відповідно генератор постійної і змінної напруги; 3 – вимірювач
змінної складової сили струму; 4 – комірка
Нехай в даному випадку застосовано звичайну
полярографічну комірку (див. рис. 22.1), в якій неполяризованим
електродом служить «ртутне дно», а поляризованим – «ртутно-
крапельний електрод». Нехай в комірці знаходиться розчин з
однією аналізованою речовиною. При дії сумарної напруги
через комірку протікатиме результуючий струм I Я,який
дорівнюватиме
I ЯIeIc , (22.1)
де Ie - електролітична складова, яка зумовлена реакцією
відновлення іонів аналізованої речовини; Ic - ємнісна складова,
яка обумовлена ємністю подвійного електричного шару.
Силу електричного струму Ieможна представити у вигляді
суми постійної I=та змінної I складових
Ie= I=+ I . (22.2)
В якості корисної (інформативної) складової в полярографах
змінного струму використовують змінну складову ( I),а
постійна складова ( I=) є завадою. В якості змінної напруги
використовують: синусоїдну, прямокутну і трапецієвидну.
Амплітуда змінного струму I залежить від поляризуючої
( )
напруги U на комірку ( I = f U ). Залежність амплітуди
змінного електролітичного струму від постійної напруги на
комірці називається полярограмоюзмінногоструму.
Для цього випадку при U U1/ 2 полярограма має максимум
(рис.22.6,б).
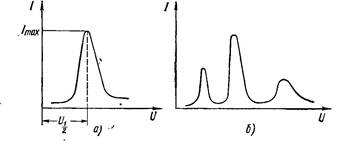
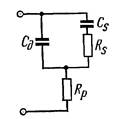
Рис. 22.6. Полярограми змінного струму для однокомпонентного (а) і
багатокомпонентного (б) розчинів
Якщо розчин є багатокомпонентним, то полярограма матиме
кілька максимумів (рис. 22.6,б). Ординатамаксимуму
пропорційна концентрації, а відповідна цьому максимуму
напруга характеризує природу речовини.
На рис.22.7 наведено еквівалентну електричну схему комірки:
Cд -ємність подвійного шару; Rp - сума послідовно увімкнених
опорів розчину, капіляра, генератора та інших елементів
вимірювального кола; Rs - активна і Cs - реактивна складові
комплексного опору комірки по змінному струму.
Рис. 22.7. Еквівалентна електрична схема комірки при накладанні на неї
змінної напруги
На сьогоднішній день полярографічний метод аналізу є
одним з найбільш чутливих і точних методів. Він дозволяє
проводити як кількісний, так і якісний аналіз розчинів.
Для застосування при автоматичному контролі технологічних
процесів однією з найбільш зручних є полярографія змінного
струму.
 -Кулонометричнийметод
-Кулонометричнийметод
Кулонометричний метод оснований на вимірюванні кількості
електрики чи струму під час електролізу досліджуваної
речовини. Фізико-хімічною основою кулонометрії є закон
Фарадея:
m
=
MIt
96500n
, (22.3)
де m - маса виділеної речовини під час її електролізу, г; M -
мольна маса даної речовини; I - сила струму, А; t - час
електролізу, с; n - кількість електронів, які беруть участь в
окисленні чи відновленні одного моля речовини.
Звідси випливає, що концентрація досліджуваної речовини
визначається або за значенням усталеного струму електролізу
при заданому сталому потенціалі, або при сталому заданому
струмі часом виділення речовини.
Кулонометричний метод застосовують для вимірювань
концентрації певного компонента (водню, кисню, двоокису
вуглецю, вуглеводнів, хлору, фтору тощо) в рідкому і газовому
середовищі, а також для вимірювань вологості газів.
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- III. Вимоги до учасників, складу груп і керівників туристських подорожей
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- L3.T4/2. Засоби переміщення рідин.
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Аеровані промивальні рідини
- Активні інгредієнти, що входять до складу препаратів для симптоматичного лікування лихоманки.
- Активні інгредієнти, що входять до складу препаратів для симптоматичного лікування сухого кашлю.
- Алфавітний підхід до вимірювання кількості інформації.
- Аналіз показників складу, структури й технічного стану основних фондів.
- Аналіз складу газів
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 20. Електрохімічні перетворювачі | | | Тема 23. Іонометрія |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |