
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тема 20. Електрохімічні перетворювачі
Змістовний модуль 7. Вимірювання складу рідин
МОДУЛЬ ІІІ
- Основніфізико-хімічніпроцесивелектрохімічному
перетворювачі
Електрохімічним називають перетворювач, виконаний у
вигляді комірки, заповненої електропровідним розчином, з
двома або декількома електродами. У загальному випадку
електроди безпосередньо беруть участь у фізико-хімічних
процесах, які відбуваються в перетворювачі, і служать для його
під’єднання у вимірювальне коло.
Вхідними перетворюваними параметрами електрохімічних
перетворювачів є хімічний склад і концентрація розчинів, а
також швидкість переміщення або тиск розчину. Вихідними
параметрами є ЕРС або електричний опір.
Розглянемо основні фізико-хімічні процеси, що відбуваються
в електрохімічному перетворювачі.
Електропровідністьрозчинів. Основним розчинником
хемічних речовин є вода. Молекула води H O2, яка є оксидом
водню, може бути подана у вигляді двох різнополярних іонів:
H+і OH −.Зв'язок між цими іонами в молекулі води сильний,
тому в дистильованій воді кількість вільних носіїв заряду дуже
обмежена, тобто дисоціація ( H O2 H++ OH −)проходить
слабко. Оскільки вода є речовиною з високою діелектричною
проникністю, то вона активно розщеплює молекули кислот,
основ і солей на позитивні та негативні іони, тобто ці речовини
активно дисоціюють у воді, утворюючи розчини.
Речовини, які розчиняються у воді (або іншому розчиннику) з
утворенням позитивних і негативних іонів, називають
електролітами. Розчини кислот, солей і основ у воді або інших
розчинниках є електропровідними і називаються провідниками
другогороду.
Дисоціація може відбуватися і без участі розчинника,
наприклад, при розплаві кристалів солей, коли за рахунок
енергії теплового руху іонів міжіонні зв'язки, що існують у
кристалі, руйнуються і в рідкій фазі з'являються вільні носії
електричних зарядів. В електрохімічному відношенні таке
середовище поводить себе як розчин, і також є провідником
другогороду.
Під дією електричного поля, яке утворюється прикладеною
до електродів напругою, позитивні іони (водню або металу)
рухаються до катода, а негативні (гідроксильні групи або
кислотні залишки) - до анода. Електропровідність розчинів
залежить від їх концентрації.
Розрізняють відсоткову, масову, молярну і нормальну
(еквівалентну) концентрації. Перша виражає відсотковий вміст
розчиненої речовини в масі розчину. Масовою концентрацією
називають відношення маси розчиненої речовини до об'єму
розчину (г/л). Молярна концентрація c визначається кількістю
молів розчиненої речовини в одиниці об'єму розчину
( г моль л/ , або кг моль м− /3). Якщо концентрація дорівнює 1
г моль л− / , розчин називають молярним. Таку концентрацію
позначають 1 М. Нормальну концентрацію виражають в грам-
еквівалентах розчиненої речовини в 1 л розчину (1 г-екв/л).
Розчин, що має концентрацію 1 г-екв/л, називають
нормальним (1 н.). Інші значення концентрації виражаються як
кратні молярній або нормальній, наприклад, 0,1 М; 0,01 М або
0,1 н.; 0,01 н.
Питома електропровідність g розчину залежить від його
концентрації і пропорційна хімічній активності розчину:
g l= fc = la , (20.1)
де f - коефіцієнт активності; l - еквівалентна
електропровідність; a - хімічна активність розчину; c - молярна
концентрація.
Коефіцієнт активності f дорівнює одиниці, якщо
концентрації розчинів дуже слабкі і зменшується у міру
підвищення концентрації. Отже, питома електропровідність є
 деякою складною функцією концентрації розчину. Треба
деякою складною функцією концентрації розчину. Треба
відзначити, що режими реальних хімічних процесів найповніше
характеризуються саме хімічною активністю. Тому на практиці
найчастіше доводиться вимірювати хімічну активність.
Рухливість іонів сильно залежить від температури розчину.
Тому електропровідність розчину також залежить від
температури. Якщо концентрації невеликі (до 0,05 н.), ця
залежність описується виразом:
g g
+ â (T T0) , (20.2)
0 1
де g , g0 - електропровідності розчину при температурах
відповідно T і
T0; â - температурний коефіцієнт
електропровідності ( â > 0 ).
При нормальній для хімічних процесів температурі (+180C )
приблизні значення â дорівнюють: 0,016 1/К для кислот; 0,019
1/К для основ і 0,024 1/К для солей. З підвищенням температури
понад 40...500C температурна залежність електропровідності
стає нелінійною, а значення â зменшується.
В темі 1 розглянуто гальванічний перетворювач для
вимірювання концентрації водневих іонів. Розглянемо
докладніше, що представляє собою водневий електрод в даному
перетворювачі.
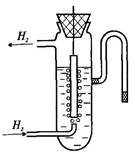
В якості водневого електрода (рис.20.1) використовують
платиновий електрод, на поверхню якого адсорбують
газоподібний водень.
Рис.20.1. Будова водневого електрода

 Значення електродних потенціалів різних речовин відносно
Значення електродних потенціалів різних речовин відносно
водневого електрода визначаються загалом властивостями самої
речовини і залежать від концентрації та температури розчину
(рівняння Нернста)
e e= +0RTln( ) , (20.3)
nF
де e0 - нормальний потенціал електрода (електродний потенціал
при
t = 180C і нормальній концентрації розчину); T -
абсолютна температура розчину, R - універсальна газова стала;
n - валентність іонів; F - стала Фарадея.
Враховуючи числові значення сталих R і F і переходячи до
десяткових логарифмів, вираз для електродного потенціалу при
t = 180C можна записати у вигляді
e e= +00,058lg( ) . (20.4)
n
Значення нормальних електродних потенціалів знаходяться в
межах -3...+3 В.
Електрокінетичніявища
Електрокінетичними називають явища, що відбуваються на
межі розділу твердої та рідкої фаз і пов'язані з їх взаємним
переміщенням. Існують прямі та зворотні електрокінетичні
ефекти. До прямих належать ефекти утворення різниці
потенціалів внаслідок руху рідини відносно твердої поверхні
тобто виникнення так званого потенціалу протікання, або за
рахунок руху частинок твердого тіла в рідині (потенціал
осідання). Зворотними є ефекти виникнення під дією
зовнішнього електричного поля руху рідини відносно твердої
поверхні - електроосмос або руху частинок твердого тіла в
рідині - електрофорез.
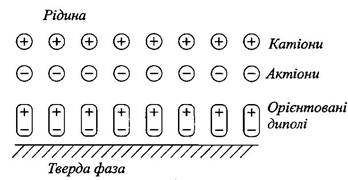
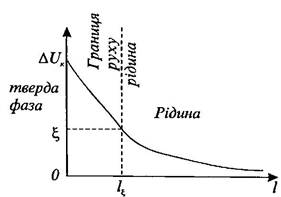
Рис. 20.2. Іонно-дипольна будова подвійного шару
Суть електрокінетичних явищ може бут пояснена наявністю
подвійного електричног шару на межі розділу твердої та рідкої
фаз. Як було показано вище, на межі твердого тіла і рідини
(розчину) виникає заряджений шар рідини дипольної будови і
відзначається стрибок потенціалу. Причиною утворення
подвійног шару може бути також специфічна (наприклад,
вибіркова) адсорбція іонів певного знака на межі розділу фаз, а
також орієнтована адсорбція полярних молекул. Іонно-дипольна
будова подвійного шару може бути зображена у такому вигляді,
як показано на рис. 20.2.
Рис. 20.3. До поняття електролітичного потенціалу
Виникнення потенціалу протікання і явища електроосмосу,
які найчастіше використовуються в електрокінетичних
перетворювачах, пов’язане з динамікою подвійного шару, коли
рідка фаза переміщується відносно твердої поверхні (стінки).
Внаслідок порівняно міцного зв'язку зарядів дипольної частини
подвійного шару з твердою поверхнею електрокінетичні ефекти
зумовлені, головним чином, зарядами дифузійної частини
подвійного шару і визначаються так званим електрокінетичним
потенціалом між площиною ковзання (границею руху) і
відповідною точкою всередині рідини, в якій електродний
потенціал дорівнює нулю (рис. 20.3).
-Гальванічніперетворювачі pH-метрів
Принцип дії гальванічних перетворювачів рН-метрів
грунтується на залежності електродних потенціалів від
активності водневих іонів, за якою можна визначити
властивості, зокрема концентрацію водних розчинів. Суть цього
способу така. Навіть найчистіша вода має деяку діелектричну
провідність, зумовлену наявністю в ній деякої кількості іонів,
які виникають у результаті реакції, яка називається
автопротолізом
H O H O H O++ OH − . (20.5)
Суть його полягає в переміщенні іонів водню H+від одних
молекул води до інших. Отже, у водневих розчинах та й у чистій
воді вільних іонів H+немає, а є гідратовані іони гідроксонію
+
H O3. Однак, для спрощення, дисоціацію подають як
−
H O2 H++ OH
, (20.6)
тобто вважають, що молекули води частково дисоціюють на
іони водню H+та іони гідроксилу OH −.
Для дистильованої води та нейтральних розчинів активність
aH+ іонів водню дорівнює активностіOH
a − іонів гідроксилу, для
водних розчинів кислот
a+> a −,і тим більша, чим більша
H
OH
концентрація, а для водних розчинів лугів
a+< a − і
H
OH


 зменшується у міру збільшення концентрації. Водночас для
зменшується у міру збільшення концентрації. Водночас для
даної температури добуток цих активностей завжди залишається
постійним як для води, так і для водних розчинів кислот і лугів, і
характеризується так званим іонним добутком води:
K
= a a − . (20.7)
H O2H OH
Встановлено, що при нормальній температурі іонний добуток
1014( )
води KH O2=− г іон л/ . У чистій воді або в нейтральному
розчині активність іонів H+та OH − однакова, тобто
a
= a = K = −
107
(
)
г іон л . (20.8)
H+
OH −
H O
/
Іонний добуток води
K
= a a − при даній температурі
H O2H OH
залишається сталим також і для будь-якого водного розчину,
зокрема для розчинів кислот із залишком іонів H+або основ із
надлишком іонів OH −.
Отже, при
K
H O2
= const для оцінки властивостей водних
розчинів достатньо виміряти, наприклад, активність водневих
іонів. На практиці для зручності обчислень активність водневих
іонів характеризують водневим показником рН, який
визначається як від'ємний логарифм активності іонів водню:
pH = −
lg
( )+= −
(
lg f cH+H+
) . (20.9)
Показник рН для водних розчинів при нормальній
температурі змінюється від 0 для сильно концентрованих
водних розчинів кислот до 14 одиниць для концентрованих
водних розчинів лугів. У розчинах неводних розчинників
показник рН залежно від концентрації буде змінюватися в інших
межах, наприклад, в аміаку 0...32,7 од.
Прилад, призначений для вимірювання рН, називають рН-
метром. Найточніший найуніверсальніший метод вимірювань
рН базується на визначенні електродних потенціалів різних
електродів, розміщених в досліджуваному розчині. Гальванічні
перетво рювачі рН-метрів складаються з двох напівелементів:
скляного вимірювального, електродний потенціал якого є
функцією
pHXдосліджуваного розчину та допоміжного, елек
тродний потенціал якого відомий і не залежить від властивостей
досліджуваного розчину.
Скляний вимірювальний напівелемент (рис. 20.4,а) - це
тонкостінна (0,05...0,1 мм) колба 1, нижня сферична частина 2
якої виготовлена із спеціального мембранного скла і заповнена
так званим буферним розчином, тобто розчином із відомим
значенням
pH0. Всередині колби розміщений хлорсрібний
допоміжний електрод 3 (платиновий стержень, покритий шаром
хлористого срібла). При зануренні такого скляного
напівелемента в досліджуваний розчин на зовнішній стінці
колби на межі скло-досліджуваний розчин виникає електродний
потенціал e1, значення якого є функцією
pHX. Це пояснюється
процесами іонного обміну. Лужні іони скла (натрій чи літій)
переходять у розчин, а їх місця займають рухливіші іони водню
із розчину. Внаслідок цього поверхневії шар скла буде
насиченим водневими іонами, а скляний електрод набуде
властивостей водневого електрода. Водночас на внутрішній
стінці колби виникає електродний потенціал e2, значення якого
зумовлене властивостями буферного розчину, не залежить від
pHXі є незмінним при незмінній температурі. Ще один
електродний потенціал e3, незалежний від
pHX, виникає на
хлорсрібному електроді. Результуючий електродний потенціал
eXвимірювального напівелемента дорівнюватиме алгебраїчній
сумі трьох вищезгаданих електродних потенціалів і міститиме
складову e0e2e3, незалежну від
pHX, та складову e1, що є
функцією вимірюваної величини pHX:
eX= + = +e0e1e0e pHpHX , (20.10)
де e0 - електродний потенціал вимірювального напівелемента
при
pHX= 0 ; epH - коефіцієнт, значення якого зумовлене
параметрами вимірювального напівелемента (питома ЕРС
електрода, мВ/рН).
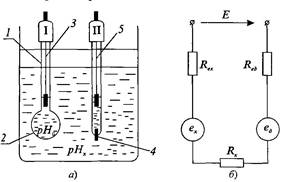
Рис. 20.4. Будова гальванічного перетворювача рН-метра та еквівалентна
електрична схема
Шар скла між обома поверхнями колби є, по суті,
провідником з великим електричним опором ( RM= 10 ...1069 Ом )
(рис. 20.4,б), який з'єднує електрично два джерела ЕРС, а саме
e1та e0.
Як допоміжний може бути використаний розглянутий вище
водневий напівелемент. Але його практичне застосування
обмежене через необхідність безперервного насичення воднем.
Тому на практиці використовують звичайно так звані хлорсрібні
чи інші напівелементи.
Допоміжний хлорсрібний напівелемент (електрод) - це
товстостінний скляний корпус, всередині якого знаходиться
срібний електрод, поміщений в 3,5 н. розчин KCl, що містить
кристал хлористого срібла. Від досліджуваного розчину
внутрішня частина електрода ізольована гумовими мембранами,
в просторі між якими знаходиться також 3,5 н. розчин KCl.
Дифузійний потенціал на поверхні розділювальної мембрани
досягає до 10 мВ. Загальний опір електрода не перевищує 20
кОм.
Допоміжний напівелемент може бути розміщений в
досліджуваному розчині чи за його межами, але в обох випадках
з'єднаний з досліджуваним розчином за допомогою відповідно
розділювальної мембрани чи електролітичного ключа. На
рис.20.4,а допоміжний напівелемент II поміщений в
досліджуваний розчин і електрично з'єднаний з ним за
допомогою електролітичного ключа 4. Еквівалентна електрична
схема такого гальванічного перетворювача наведена на
рис.20.4,б. Тут eXі eд -відповідно електродні потенціали
вимірювального та допоміжного напівелементів, Rexта Reд -
відповідно повні опіри вимірювального та допоміжного
електродів; Rк -опір електролітичного ключа.
Вихідною величиною такого гальванічного перетворювача
буде різниця електродних потенціалів
= − = − +e e e pH = E + e pH . (20.11)
E exeд
д pH
pH
Основними складовими похибками рН-метрів є температурна
похибка, а також дифузійні потенціали. Для зменшення
температурної похибки застосовують електричні кола
температурної корекції, а для зменшення дифузійних
потенціалів - з'єднання напівелементів через електролітичний
ключ.
Читайте також:
- Аналіз двотактних перетворювачів напруги
- Аналогово-цифрові, цифро-аналогові перетворювачі. Кодоперетворювачі
- Важливою ознакою класифікації є принцип побудови перетворювачів кодів, згідно з яким їх можна поділити на чотири групи.
- Взаємоіндуктивні перетворювачі
- Вимірювальні кола взаємоіндуктивних перетворювачів
- Вимірювальні кола ємнісних перетворювачів
- Вимірювальні кола реостатних перетворювачів
- Вимірювальні перетворювачі
- Високочастотні перетворювачі модульної структури
- Вторинні перетворювачі вимірювальної інформації
- Гальванічні перетворювачі рН-метрів
- Електрокінетичні перетворювачі
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 17. Поплавкові і гідравлічні рівнеміри | | | Вимірювання хімічного складу рідин |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |