
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Калорійність і вміст поживних речовин у продуктах харчування
| Продукти | Загальна калорійність | Вміст, % | Вміст вітамінів і мінеральних речовин, мг | ||||||
| білки | вуглеводи | жири | вітамін А | вітамін С | вітамін В | ССа | FFе | ||
| Какао, ¾ стакана (188г) | 11,8 | 00,077 | 00,59 | ||||||
| Сметана. 1 ст. ложка (12г) | 00,1 | 00,004 | 00,1 | ||||||
| Йогурт, 1 стакан (222г) | 11,36 | 00,077 | 00,14 | ||||||
| Молоко, 1 стакан (244г) | 22,29 | 00,093 | 00,12 | ||||||
| Яєчня. з 1 яйця (46г) | 00,033 | 00,92 | |||||||
| Яблуко (138г) | 1,3 | 00,04 | 00,4 | ||||||
| Банан (119г) | 11,7 | 00,06 | 00,8 | ||||||
| Буряк 1/2стакана (83г) | 00,01 | 00,6 | |||||||
| Морква. 1/2стакана (73г) | 00,04 | 00,4 | |||||||
| Ананас (122г) | 1,5 | 00,9 | 00,1 | 11,3 | 00,4 |
´ Контрольні запитання
1. Які питання вирішує термодинаміка?
2. Які принципові питання розглядає хімічна термодинаміка?
3. Дайте визначення системи.
4. Наведіть класифікацію систем за характером взаємодії з навколишнім середовищем.
5. Що називається параметрами стану?
6. Що називається термодинамічним процесом?
7. Дайте різні формулювання першого закону термодинаміки.
8. В якому співвідношенні знаходяться ентальпія і внутрішня енергія системи?
9. Які умови називаються стандартними?
10. Чим відрізняються термохімічні рівняння від хімічних?
11. Що таке стандартна ентальпія утворення?
12 Сформулюйте закон Гесса.
13. Поясніть наслідки закону Гесса, наведіть відповідні приклади.
14. Обчисліть стандартну теплоту утворення бензолу з простих речовин, якщо ентальпія згоряння бензолу ΔН озгор.(С6 Н6) = - 3267,6 кДж/моль, а ентальпія утворення оксиду вуглецю (IV) і води відповідно рівні ΔНоутв.(СО2) = - 393,51кДж/моль і ΔНоутв.(Н2О) = - 281 кДж/моль.
15. Обчисліть при температурі 298К і тиску 101,3 кПа тепловий ефект ΔН° реакції: Fе2О3 + 2А1 = А12О3 + 2Fе,
якщо відомо:
ΔНоутв(Fе2О3) = -822,5 кДж/моль;
ΔН0утв.(А12О3) = - 670,6 кДж/моль.
16. Якими довідниковими величинами користуються для розрахунку теплового ефекту реакції?
17. Що таке калорійність?
18. Сформулюйте другий закон термодинаміки.
19 Що таке ентропія?
20. Як змінюється ентропія системи при розширенні газу? При утворенні кристалів у насиченому розчині?
21. Які термодинамічні фактори визначають направлення хімічних реакцій?
22. Яке значення повинна мати енергія Гіббса для реакцій, що самодовільно відбуваються?
23 Яке значення має ізобарно-ізотермічний потенціал у рівноважній системі?
24. Як розрахувати зміну енергії Гіббса для хімічної реакції?
25. В чому полягає особливість живих організмів як об'єктів термодинамічних досліджень?
26. Творче завдання: Підготувати розповідь з теми: «Яким було б життя, якби людство не знало законів фізичної хімії»
J Тест на тему "Основи хімічної термодинаміки"
| Питання | Варіанти відповіді |
| 1. Ентропія ізольованої системи | а) .. .зменшується і в стані рівноваги набуває свого мінімального значення; б).. .збільшується і в стані рівноваги набуває свого максимального значення ; в)... зменшується і в стані рівноваги набуває свого максимального значення; г)... збільшується і в стані рівноваги набуває свого мінімального значення. |
| 2. Основні параметри хімічної термодинаміки : | а) об'єм, маса, температура, моляльність; б ) тиск, об'єм, температура, концентрація; в) молярна маса, тиск, концентрація, кількість теплоти ; г) температура, об'ємна частка речовини, моль, стандартна ентальпія. |
| 3. Перший закон термодинаміки: | а) А=Р(V2 – V1) в) ΔU = Q - A б) Q = ΔH г) Q = CmΔt. |
| 4. Енергія Гіббса розраховується за формулою: | а) G =ТΔS + ΔH; г) G = ΔH- ТΔS; б) G = ΔH - S; д) G = ΔS -ТΔH . в) G = TΔS - ΔH ; |
| 5. Енергію Гельмгольца розраховують за формулою: | а) F = ΔS - ТΔH б) F = ΔU - ΔS; в) F = ΔU – ТΔS г) F= ТΔS - ΔU д) F = U + ТΔS. |
| 6. Другий закон термодинаміки: | а) “Самодовільно можуть відбуватися лише такі процеси, у резу-льтаті яких вирівнюються ті або інші фактори інтенсивності” ; б) “Самодовільно можуть відбуватися лише такі процеси , у ре-зультаті яких вирівнюються ті або інші фактори екстенсивності”; в) “Самодовільно можуть відбуватися лише такі процеси, у резу-льтаті яких не вирівнюються ті або інші фактори екстенсивності”. |
| 7. Ентропію вимірюють: | а) (S) = 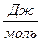 ; б) (S) = ; б) (S) =  ; в) ; в) 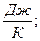 г) г)  д) д) 
|
| 8. Ізохорно-ізотермічний потенціал в хімічних реакціях розраховують за рівнянням : | а) ΔG =  (ΔGутв.)вих - (ΔGутв.)вих -  (ΔGутв.)кін. ;
б) ΔG = (ΔGутв.)кін. ;
б) ΔG =  (ΔGутв.)вих + (ΔGутв.)вих +  (ΔGутв.)кін. ;
в) ΔG = (ΔGутв.)кін. ;
в) ΔG =  (ΔGутв.)кін - (ΔGутв.)кін -  (ΔGутв.)вих.;
г) ΔG = (ΔGутв.)вих.;
г) ΔG =  (ΔGутв.)кін + (ΔGутв.)кін +  (ΔGутв.)вих. (ΔGутв.)вих.
|
| 9. Екстенсивні величини: | а) об'єм , теплоємність, тиск, температура; б) маса, об'єм , теплоємність; в) тиск, маса, ентальпія, концентрація. |
| 10. Хімічна термодинаміка... | а ) вивчає хімічні і фізичні процеси, але не торкається механізмів реакцій ; б ) вивчає хімічні процеси і торкається механізмів реакції; в ) вивчає лише сумарні результати реакцій залежно від заданих умов. |
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- II. Харчування
- IV. Запасні речовини
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Абсорбція лікарської речовини в організмі.
- Аварії з викидом (загрозою викиду) сильнодіючих отруйних речовин на об'єктах економіки.
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аварії з викидом радіоактивних речовин у навколишнє середовище
- Аварії з викидом сильнодіючих отруйних речовин (СДОР)
- Аварії з витоком сильнодіючих отруйних речовин
- Аваріїз витоком сильнодіючих отруйних речовин.
| <== попередня сторінка | | | наступна сторінка ==> |
| Термодинаміка біохімічних процесів | | | ТЕМА 1.2. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |