
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Загальні відомості
У поверхневих водах суходолу завжди містяться розчинені гази, які надходять у воду за її контакту з атмосферним повітрям і внаслідок перебігу фізико-хімічних та біологічних процесів. Найважливішими серед них з еколого- токсикологічного погляду є кисень, діоксид вуглецю і сірководень. Інші гази, такі як метан, хлор тощо, потрапляють у природні води за специфічних умов, їх визначають під час спеціальних досліджень.
Кисень
Головними джерелами надходження кисню в поверхневі води суходолу є фотосинтетична діяльність водяних організмів та абсорбція з атмосфери.
Фотосинтетичне продукування кисню відбувається в поверхневому шарі водойми, товщина якого залежить від прозорості води і коливається від кількох десятків сантиметрів до кількох десятків метрів. Кисень з атмосфери адсорбується на поверхні водойми, процес інтенсифікується зі зниженням тем ператури й підвищенням атмосферного тиску. Кисень надходить у водойми також із дощовими водами, які ним пересичені.
Споживання кисню, тобто зменшення його концентрації у природних водах, пов'язано з хімічними й біохімічними процесами окиснення органічних та деяких неорганічних речовин (Fе2+, Мn2+, NH4+, NO2-, Н2S, СН4, Н2 тощо). Швидкість споживання кисню зростає з підвищенням температури, збільшенням кількості бактерій та інших водяних організмів, які піддаються хімічному й біологічному окисненню.
Розчинений кисень у поверхневих водах міститься у вигляді молекул 02. Залежність розчинності кисню від температури в дистильованій воді за нормального тиску наведено в табл. 2.1. Розчинність кисню за нормального тиску називають нормальною концентрацією. Насичення води киснем, яке відповідає нормальній концентрації, взято за 100%. Концентрацію розчиненого кисню виражають у мг 02/дм3 або у відсотках насичення, яке обчислюють за рівнянням
O2% = 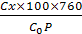 (2.1)
(2.1)
де Сх — концентрація кисню, визначена експериментально, мг 02/дм3; Со — нормальна концентрація за певної температури, яку визначають за даними табл. 2.1, мг 02/дм3; Р — атмосферний тиск у момент проведення аналізу, мм рт.ст.
Таблиця 2.1. Залежність нормальної концентрації кисню (Со) у воді
від температури (за атмосферного тиску 760 мм рт. ст.)
|
У поверхневих водах суходолу концентрація розчиненого кисню може змінюватись від 0 до 14 мг О2/дм3 залежно від інтенсивності двох протилежно спрямованих процесів — надходження і споживання — і як правило не перевищує 100%-го насичення. Однак за інтенсивного фотосинтезу, зокрема під час «цвітіння» води, у поверхневому шарі насиченість води киснем може перевищувати 100 %.
У незабруднених водах концентрація розчиненого кисню влітку вища, ніж взимку, а в поверхневих шарах вища, ніж у придонних. Глибинна стратифікація залежить і від інтенсивності перемішування водних мас. Вона спостерігається у великих річках, озерах, водоймах, ставках — особливо в штильову погоду. Оскільки основним постачальником кисню в поверхневі води є фотосинтез водяними рослинами» то найбільше насичення води киснем спостерігається близько 14 - 15, особливо в сонячну погоду, а найменше — близько 4 - 6-ї години.
Розчинність кисню у воді залежить не тільки від її температури, а й мінералізації води:
| Температура, °С | ||||
| Зменшення розчинності, мг 02/дм3 на кожні 1000 мг солей | 0,08405 | 0,06217 | 0,04777 | 0,04885 |
Коливання вмісту кисню у воді упродовж доби може досягати 2 – 4 мг 02/дм3. Тому для характеристики кисневого режиму певного водного об'єкта потрібно проводити серійний аналіз, відбирати проби води з різних глибин, у різних точках акваторії та в різні години доби.
Для визначення вмісту кисню в природних водах запропоновано багато методів, які ґрунтуються на різних принципах. Для систематичного контролю вмісту кисню в поверхневих водах суходолу рекомендовано титриметричний йодометричний (за Вінклером) та електрохімічний методи.
Йодометричне визначення
Йодометричне визначення кисню проводять у два етапи: фіксують розчинений кисень відразу на місці відбирання проби води і титрують пробу; титрування можна виконувати через деякий час після фіксування, але не пізніше ніж через 1 добу. Метод використовують для аналізу незабарвлених або слабко забарвлених вод із вмістом кисню не менш як 0,05 мг 02/дм3.
Принцип методу. Метод ґрунтується на взаємодії розчиненого у воді кисню з гідроксидом мангану в лужному середовищі:
2Мn(ОН)2↓ + 02 = 2МnО(ОН)2↓.
При цьому розчинений кисень фіксується. Далі, під час розчинення осаду МnО(ОН)2 в кислоті (рН < 1) за надлишку йодиду калію, виділяється йод, кількість якого еквівалентна вмісту розчиненого кисню:
МnО(ОН)2↓ + 2КІ + 2Н2S04 = МnSО4 +І2 + К2S04 + 3H20.
Йод, що виділився, титрують розчином тіосульфату натрію за наявності крохмалю як індикатору:
І2 + 2Nа2S203 = 2NаІ + Nа2S406.
За об'ємом витраченого на титрування розчину тіосульфату натрію обчислюють вміст кисню у воді.
Визначенню кисню цим методом заважають великі кількості суспендованих часточок (зависей). Їх видаляють добавлянням до 1 дм3 проби води перед фіксуванням кисню 10 см3 10%-го розчину алюмокалієвого галуну і 2 см3 концентрованого розчину аміаку. Після відстоювання пробу за допомогою сифона переносять у кисневу склянку. Якщо проба містить органічні зависі, що погано осідають, то її прояснюють. Для цього відразу після відбирання до 1дм3 проби води добавляють 10 см3 суміші розчинів сульфамінової кислоти і хлориду ртуті (32 г сульфамінової кислоти розчиняють у 450 см3 бідистильо- ваної води; 54 г хлориду ртуті розчиняють при нагріванні у 450 см3 бідисти- льованої води; обидва розчини змішують і доводять об'єм бідистильованою водою до 1 дм3).
Якщо у пробі води вміст нітритного азоту перевищує 0,05 мг N/дм3, то перед розчиненням осаду МnО(ОН)2 у кислоті в склянку вносять кілька крапель 5%-го розчину азиду натрію або 40%-го розчину сульфамінової кислоти чи сечовини.
Якщо вміст заліза(ІІІ) понад 1 мг Fе/дм3, то до проби перед розчиненням гідроксидів у кислоті добавляють 1 см3 40%-го розчину фториду калію. Після підкислення проби швидко відтитровують йод, який виділився.
Читайте також:
- I. Загальні збори АТ
- I. ЗАГАЛЬНІ МЕТОДИЧНІ ВКАЗІВКИ
- I. Загальні положення
- II. ЗАГАЛЬНІ ПОЛОЖЕННЯ.
- IX. Відомості про військовий облік
- IX. Відомості про військовий облік
- Q Конституція України від 28 червня 1996 р. // Відомості Верховної Ради України – 1996 - № 30 – Ст. 141
- V Практично всі психічні процеси роблять свій внесок в специфіку організації свідомості та самосвідомості.
- XXXIII. ЗАГАЛЬНІ ПРОФЕСІЇ (У ВСІХ ГАЛУЗЯХ ГОСПОДАРСТВА)
- А) загальні критерії
- Білковий обмін: загальні відомості
- Біографічні відомості
| <== попередня сторінка | | | наступна сторінка ==> |
| Порядок виконання роботи | | | Установки, прилади, лабораторний посуд, реактиви |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |