
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Рівняння молекулярно-кінетичної теорії ідеального газу для тиску
У молекулярно-кінетичній теорії користуються моделлю ідеального газу, що задовольняє такі умови:
1) власний об'єм молекул газу нехтовно малий порівняно з об'ємом посудини;
2) між молекулами газу відсутні силпи взаємодії;
3) зіткнення молекул газу між собою і зі стінками посудини абсолютно пружні.
Модель ідеального газу можна використати, вивчаючи реальні гази, оскільки вони при умовах, близьких до нормальних, а також при низьких тисках і високих температурах близькі за своїми властивостями до ідеального газу.
Основне рівняння молекулярно-кінетичної теорії пов'язує параметри газу з характеристиками руху його молекул, тобто встановлює залежність між тиском і об'ємом газу та кінетичною енергією поступального руху його молекул.
Тиск газу в посудині є результатом, зіткнення молекул газу із стінками посудини. Тиск газу є макроскопічним проявом руху молекул.
Розглянемо однорідний газ, який поміщений в посудину кубічної форми. Напрямимо осі системи відліку вздовж ребер куба (рис. 38). Нехай певна молекула М рухається в посудині зі швидкістю v. Швидкість v можна розкласти на три складові координатних осей:
v =vx + vy + vz.
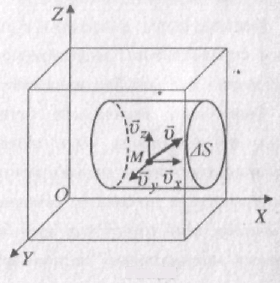 Виділимо на стінці посудини елементарну площину DS, яка перпендикулярна до осі X. При кожному зіткненні молекула передає площині імпульс 2m0vx , де m0 – маса молекули. За час Dt площини досягнуть ті молекули, які знаходяться в об’ємі циліндра з основою DS і висотою vxDt. Кількість цих молекул дорівнює nDSvxDt, де n - кількість молекул в одиниці об’єму газу. З них тільки половина потрапляє на площину DS. Решта через повну безладність молекулярних рухів рухаеться не до стінки, а від неї. За час Dt об площину DS ударяються Nx = 1/2nDSDtvx молекул газу.
Виділимо на стінці посудини елементарну площину DS, яка перпендикулярна до осі X. При кожному зіткненні молекула передає площині імпульс 2m0vx , де m0 – маса молекули. За час Dt площини досягнуть ті молекули, які знаходяться в об’ємі циліндра з основою DS і висотою vxDt. Кількість цих молекул дорівнює nDSvxDt, де n - кількість молекул в одиниці об’єму газу. З них тільки половина потрапляє на площину DS. Решта через повну безладність молекулярних рухів рухаеться не до стінки, а від неї. За час Dt об площину DS ударяються Nx = 1/2nDSDtvx молекул газу.
Загальний імпульс, який переданий молекулами площини DPx = =2m0v1xN2x + 2m0v2xN2x + … +2m0vlxNlx = m0DSDt(n1v21x + n2v22x + … +nl2lx), n1,n2…nn – кількість молекул, що мають швидкості v1,v2…vn, відповідно. Тиск газу на площину DS
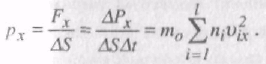 Зважаючи на цілковиту хаотичність рухів молекул, тиск газу в будь-якому нанрямку повинен бути однаковий, тобто
Зважаючи на цілковиту хаотичність рухів молекул, тиск газу в будь-якому нанрямку повинен бути однаковий, тобто
px = py = pz = p.
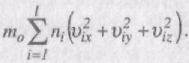 Додамо почленно рівняння для px, py i pz:
Додамо почленно рівняння для px, py i pz:
 px + py+ pz = 3p =
px + py+ pz = 3p =
 Через те, що v2ix + v2iy + v2iz = v2i , то
Через те, що v2ix + v2iy + v2iz = v2i , то
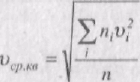 Величина - це сума квадратів швидкостей усіх молекул в одиниці об'єму газу. При великій кількості молекул немає потреби знати значення квадрита швидкості кожної молекули. Тому знайдемо середнє значення цієї величини. За визначенням
Величина - це сума квадратів швидкостей усіх молекул в одиниці об'єму газу. При великій кількості молекул немає потреби знати значення квадрита швидкості кожної молекули. Тому знайдемо середнє значення цієї величини. За визначенням

Величина
називається середньою квадратичною швидкістю.
 В результаті тиск газу дорівнюватиме:
В результаті тиск газу дорівнюватиме:
Це рівняння називається основним рівнянням молекулярно-кінетичної теорії ідеального газу для тиску.
 Знайдену формулу перепишемо у вигляді:
Знайдену формулу перепишемо у вигляді:
 де <eк> - середня кінетична енергія поступального руху однієї молекули газу.
де <eк> - середня кінетична енергія поступального руху однієї молекули газу.
 Густина газу
Густина газу
Тоді
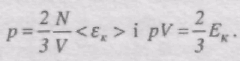 Оскільки кінетична енергія поступального руху молекул газу Еk = =N<eк>, то
Оскільки кінетична енергія поступального руху молекул газу Еk = =N<eк>, то
 Це рівняння перепишемо так чином:
Це рівняння перепишемо так чином:
де m = Nm0 - маса газу.
Для одного моля газу m = m і V = Vm.
Тоді pVm = 1/3mv2ср.кв.
З іншого боку, за рівнянням Менделєєва-Клапейрона
pVm = RT
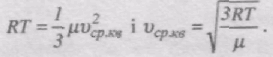 Отже,
Отже,
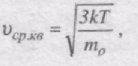
Оскільки m =moNA, R = kNA , де k - стала Больцмана, то
З рівняння Менделєєва-Клапейрона

101. Середня кінетична енергія
молекул. Молекулярно-кінетичне
трактування абсолютної температури
Знайдемо вираз для середньої кінетичної енергії поступального руху молекули ідеального газу:
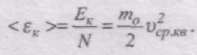
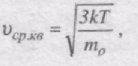 Оскільки
Оскільки
 То
То
 Отже, середня кінетична енергія поступального руху молекул ідеального газу залежить тільки від його абсолютної температури, <eк> прямо пропорційна до Т.
Отже, середня кінетична енергія поступального руху молекул ідеального газу залежить тільки від його абсолютної температури, <eк> прямо пропорційна до Т.
На рис. 39 зображено залежність <eк> від Т. Якщо T = 0, <eк> = 0, тобто припиняється поступальний рух молекул газу, а отже, дорівнює нулю і його тиск.
Отже, абсолютна температура є міра середньої кінетичної енергії поступального руху молекул.
Однак в області температур, близьких до абсолютного нуля, поведінка молекул описується не класичними законами, а законами квантової механіки.
102. Розподіл Максвелла молекул
ідеального газу за швидкостями
теплового руху
Внаслідок безперервного хаотичного руху молекул, а також взаємного зіткнення молекул піл час цього руху кожна молекула зокрема може змінювати свою швидкість як за величиною, так і за напрямком. Тому в газі будуть як швидкі, так і повільні молекули. Але, хоча швидкості окремих молекул змінюються, властивості газу у стані термодинамічної рівноваги загалом при цьому не змінюються: залишаються постійними параметри системи. Зумовлено це тим, що швидкості газових молекул підлягають певному законові, тобто, незважаючи на повну хаотичність молекулярних рухів, розподіл молекул за швидкостями виявляється не випадковим, а цілком визначеним. До того ж він є однозначним і єдино можливим.
Дж. Максвелл теоретично розв'язав задачу про розподіл молекул ідеального газу за швидкостями поступального руху. Він встановив закон, шо дає змогу визначити, яка кількість молекул dn із загальної кількості n молекул ідеального газу в одиниці об'єму мають при даній температурі швидкості, які лежать в інтервалі від v до v + dv. Дж. Максвелл вважав, що газ складається з великої кількості n однакових молекул, температура в усіх частинах посудини з газом теж однакова і відсутні зовнішні дії на газ.
Якщо розбити діапазон швидкостей молекул на малі інтервали, які дорівнюють dv, то на кожний інтервал швидкості припадатиме деяка кількість молекул dn(v), що мають швидкість в інтервалі dv.
Закон Максвелла описусться деякою функцією f(v), шо називається
функцією розподілу молекул за швидкостями руху.
 Ця функція визначає відносну кількість молекул швидкості яких лежать в інтервалі від v до v + dv, тобто
Ця функція визначає відносну кількість молекул швидкості яких лежать в інтервалі від v до v + dv, тобто
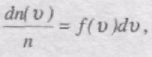
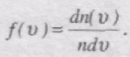 звідси
звідси
Застосовуючи методи теорії імовірності, Максвелл знайшов функцію f(v) у такому вигляді:
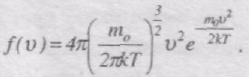
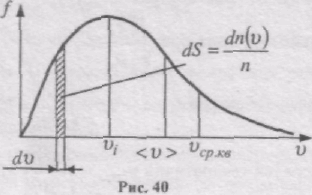 Конкретний вигляд функції залежить від роду газу (m0) і від параметра стану (Т). Графік функції f(v) наведений на рис. 40. Функція f(v) починається від нуля, досягає максимуму, а потім асимптотично пряму до нуля. Крива несиметрична відносно максимального значення f(v). Відносна кількість молекул dn(v)/n, швидкості яких лежать в інтервалі від v до v + dv, числово дорівнює площі заштрихованої ділянки на рис. 40.
Конкретний вигляд функції залежить від роду газу (m0) і від параметра стану (Т). Графік функції f(v) наведений на рис. 40. Функція f(v) починається від нуля, досягає максимуму, а потім асимптотично пряму до нуля. Крива несиметрична відносно максимального значення f(v). Відносна кількість молекул dn(v)/n, швидкості яких лежать в інтервалі від v до v + dv, числово дорівнює площі заштрихованої ділянки на рис. 40.
 Вся площа, обмежена кривою розподілу і віссю абсцис, числово дорівнює кількості молекул, швидкості яких мають різні значення від 0 до µ. Оскільки цю умову задовольняють всі n молекул, то площа, що розглядається, дорівнює одиниці:
Вся площа, обмежена кривою розподілу і віссю абсцис, числово дорівнює кількості молекул, швидкості яких мають різні значення від 0 до µ. Оскільки цю умову задовольняють всі n молекул, то площа, що розглядається, дорівнює одиниці:
Швидкість, при якій f(v) максимальна, називається найімовірнішою швидкістю vi.
Використовуючи умову максимуму виразу f(v), можна знайти вираз для найімовірнішої швидкості:
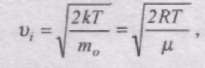

оскільки
Середня арифметична швидкість молекул <v> визначається за формулою
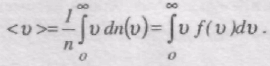
Підставляючи сюди f(v) й інтегруючи, отримаємо
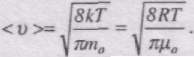
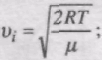 Отже, є три швидкості, які характеризують стан газу (рис. 40):
Отже, є три швидкості, які характеризують стан газу (рис. 40):
найімовірніша
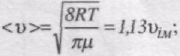
середня арифметична
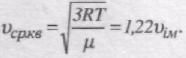
середня квадратична
При збільшенні температури (або зменшенні маси молекул) максимум кривої f(v) зміщується у бік більших швидкостей, а його абсолютна величина зменшується, причому площа, яка охоплена кривою f(v) і віссю v, залишається незмінною.
 Закон Максвелла зручно формулювати, ввівши відносну швидкість
Закон Максвелла зручно формулювати, ввівши відносну швидкість
де v - дана швидкість, а vi - найімовірніша швидкість для
молекул даного газу при даній температурі.
Розподіл, який визначає кількість молекул, відносні швидкості яких лежать у межах від uв до uв + duв , має такий вигляд:

 Знайдемо середню відносну швидкість молекул ідеального газу:
Знайдемо середню відносну швидкість молекул ідеального газу:
де <v> - середня арифметична швидкість.
103. Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
Якщо на молекули не діють зовнішні сили, то вони рівномірно розподіляються по об'єму посудини. Однак молекули будь-якого газу завжди перебувають в полі сил тяжіння Землі. Якби не було тяжіння, то атмосферне повітря розсіялося б по всьому Всесвіту. Якби не було теплового руху молекул атмосферного повітря, то всі вони впали б на Землю.
Тяжіння і тепловий рух приводять до стаціонарного стану газу, при якому його тиск і концентрація зменшується з висотою.
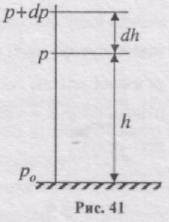 Розглянемо ідеальний газ, маса всіх мекул якого однакова, температура постійна і який знаходиться в однорідному полі тяжіння. Якщо тиск газу на висоті h дорівнює p (рис.41), то на висоті h + dh він дорівнює p + dp, причому при dh > 0 dp <0, оскільки тиск з висотою зменшується.
Розглянемо ідеальний газ, маса всіх мекул якого однакова, температура постійна і який знаходиться в однорідному полі тяжіння. Якщо тиск газу на висоті h дорівнює p (рис.41), то на висоті h + dh він дорівнює p + dp, причому при dh > 0 dp <0, оскільки тиск з висотою зменшується.
Різниця тиску р і р+dp числово дорівнює вазі газу, що знаходиться в об'ємі циліндра заввишки dh, а площа основи, що дорівнює одиниці: p - (p + dp) = rgdh, де r - густина газу на висоті h.
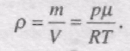 Використаємо рівняння Менделєєва-Клапейрона
Використаємо рівняння Менделєєва-Клапейрона
Звідси густина газу
 Тоді
Тоді
Вважаючи Т = соnst й ітегруючи по тиску від р0 до р, а по висоті від 0 до h, отримуємо
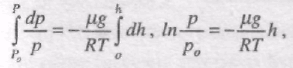
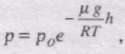 звідси
звідси
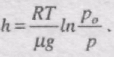
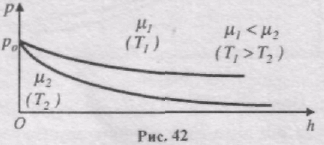 Ці формули називаються барометричними формулами. Із них можна зробити висновок, що тиск газу зменшується із висотою експоненціально і тим швидше, чим важчий газ (чим більше m) і чим нижча температура (рис. 42).
Ці формули називаються барометричними формулами. Із них можна зробити висновок, що тиск газу зменшується із висотою експоненціально і тим швидше, чим важчий газ (чим більше m) і чим нижча температура (рис. 42).
Барометрична формула дає змогу знайти співвідношення між концентраціями газу на різній висоті. Використаємо рівняння стану ідеального газу у вигляді р = = nkt, де n - концeнтрація молекул газу. При Т = соnst отримуємо
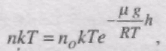
де n0 - концепція молекул на висоті h = 0.
Оскільки m = m0NA, a R = kNA, то
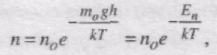
де Еn - потенціальна енергія молекул в полі тяжіння. Отриманий вираз називається розподілом Больцмана у зовнішньому потенціальному полі.
Із збільшенням висоти концентрація молекул газу зменшується за експоненціальним законом (рис. 43). При високих температурах кількість молекул n незначно зменшується з висотою і при Т µ n n0 , тобто підвищення температури викликає вирівнювання концентрації газу за висотою.
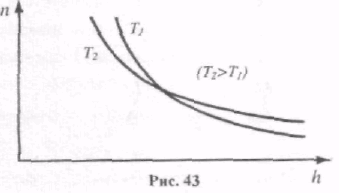
При Т 0К n 0, тобто всі молекули під дією сили тяжіння опускаються на дно посудини.
104. Закон рівномірного розподілу енергії за ступенями вільності молекул
Числом ступенів вільності називають найменше число координат, які необхідно задати для того, щоб повністю визначити положення тіла у просторі, або кількість незалежних рухів, які може виконувати тіло.
Матеріальна точка, шо довільно рухається у просторі, має три ступені вільності (x,у,z). Якщо ця точка рухається по деякій поверхні або вздовж певної кривої, то вона відповідно має два або один ступені вільності.
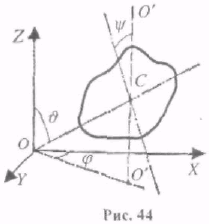 Абсолютно тверде тіло має 6 ступенів вільності. Щоб визначити його положення в просторі, треба задати три координати (х,y,z) (3 ступені вільності поступального руху) центра мас тіла (рис. 44); два кути J і j визначають положення в просторі певної осі (О'О'), яка проходить через центр мас і якунебудь іншу фіксовану точку тіла і необхідно задати кут y, який визначає напрямок другої, зв'язаної з тілом осі, яка перпендикулярна до першої (J,j,y - 3 ступені вільності обертального руху).
Абсолютно тверде тіло має 6 ступенів вільності. Щоб визначити його положення в просторі, треба задати три координати (х,y,z) (3 ступені вільності поступального руху) центра мас тіла (рис. 44); два кути J і j визначають положення в просторі певної осі (О'О'), яка проходить через центр мас і якунебудь іншу фіксовану точку тіла і необхідно задати кут y, який визначає напрямок другої, зв'язаної з тілом осі, яка перпендикулярна до першої (J,j,y - 3 ступені вільності обертального руху).
Якшо тіло не абсолютно тверде і його частини можуть змінюватись одна відносно одної, то необхідно внести ще додаткові ступені вільності коливального руху.
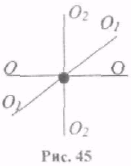 Молекули одноатомного газу можна розглядати як матеріальні точки на тій підставі, що маса такої частинки зосереджена в ядрі, розміри якого дуже малі. Молекула одноатомного газу має три ступені вільності поступального руху (рис. 45).
Молекули одноатомного газу можна розглядати як матеріальні точки на тій підставі, що маса такої частинки зосереджена в ядрі, розміри якого дуже малі. Молекула одноатомного газу має три ступені вільності поступального руху (рис. 45).
Внаслідок хаотичності теплового руху молекул ідеальною газу в середньому на кожний ступінь вільності поступального руху одноатомної молекули припадає однакова кінетична енергія <eк1>, що дорівнює одній третині середньої кінетичної енергії молекули
 Отже,
Отже,
Молекули, що складаються з двох, трьох і більшої кількості атомів, не можуть бути уподібнені до матеріальних точок.
Молекула двоатомного газу в першому наближенні - це два жорстко зв'язані атоми, що перебувають на деякій відстані один від одного. Положення такої системи можна визначити, якщо задати три координати центра мас системи і два куги J і j, які визначають напрямок у просторі осі системи.
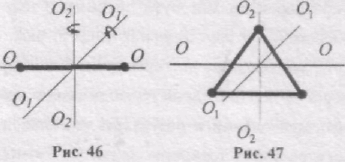 Отже три ступені вільності будуть поступальними, а дві - обертальними навколо осей О1-О1, і О2-О2 (рис. 46). Обертання навколо третьої осі О-О розглядати не треба, бо момент інерції атомів відносно цієї осі дуже малий.
Отже три ступені вільності будуть поступальними, а дві - обертальними навколо осей О1-О1, і О2-О2 (рис. 46). Обертання навколо третьої осі О-О розглядати не треба, бо момент інерції атомів відносно цієї осі дуже малий.
Триатомна і багатоатомні нелінійні молекули (рис. 47) мають 6 ступенів вільності - 3 поступальні і 3 обертальні. Жорсткого зв'язку між атомами не існує. Тому для реальних молекул необхідно враховувати також ступені вільності коливного руху.
У класичній статистичній фізиці виводиться закон Больцмана про рівномірний розподіл енергій за ступенями вільності молекул: для статичної системи, що перебуває у стані термодинамічної рівноваги, на кожний поступальний і обертальний ступінь вільності припадає б середньому кінетична енергія, що дорівнює kT/2, а на кожний коливний ступінь вільності - в середньому енергія kT.
Коливний ступінь мас вдвоє більшу енергію тому, що на нього припадає не лише кінетична енергія (як у разі поступального і обертального руху), але і потенціальна енергія, причому середні значення кінетичної і потенціальної енергій однакові:
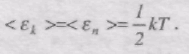
 Таким чином, середня енергія молекули
Таким чином, середня енергія молекули
де і = іпост + іоб +2ікол.
Важливою характеристикою термодинамічної системи є її внутрішня енергія U - енергія хаотичного (теплового) руху мікрочастинок системи (молекул, атомів, електронів, ядер і тощо) і енергія взаємодії цих частинок. До внутрішньої енергії не належать кінетична енергія системи як цілого і потенціальна енергія системи у зовнішніх полях.
Внутрішня енергія - однозначна функція термодинамічного стану системи, тобто в кожному стані система має цілком визначене значення внутрішньої енергії. Стан системи, в якому U = 0, цілком довільний, оскільки в термодинаміці інтерес становить не сама внутрішня енергія U системи, а її зміна DU при зміні стану системи.
В ідеальному газі немає сил взаємодії між молекулами, а отже, дорівнює нулю взаємна потенціальна енергія молекул. Тому для моля ідеального газу внутрішня енергія дорівнює сумі кінетичних енергій NA молекул:
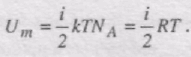
Якщо є n = m/m молів газу, то його внутрішня енергія

Внутрішня енергія ідеального газу залежить від кількості ступенів вільності молекул і абсолютної температури газу.
Лекція №40
105. Перший закон термодинаміки. Робота газу при зміні його об'єму
Розглянемо термодинамічну систему, для якої механічна енергія не змінюється, а змінюється лише її внутрішня енергія. Можливі дві форми передавання енергії від одного тіла до іншого, а отже, і зміни внутрішньої енергії системи.
Перша з них зводиться до того, що енергія впорядкованого руху одного тіла переходить в енергію впорядкованого руху іншого тіла або його частин. Це може відбуватись під час взаємодії макроскопічних тіл, розміри яких у багато разів більші за розміри окремих атомів або молекул. Таку форму передавання енергії називають роботою. Наприклад, газ, що розширюється в циліндрі двигуна внутрішнього зго-ряння, переміщуе при цьому поршень і передає йому енергію у формі роботи.
Друга форма передавання енергії здійснюється при безпосередньому обміні енергією між частинками взаємодіючих тіл, що рухаються хаотично. За рахунок переданої тілу енергії підсилюється невпорядкований рух його частинок, тобто збільшується внутрішня енергія тіла. Таку форму передавання енергії в термодинаміці називають теплотою. Так, наприклад, при дотику холодного тіла і гарячого молекули другого тіла, які швидко рухаються, стикаються з молекулами першого тіла, що рухається повільніше, і передають їм частину своєї кінетичної енергії. Внаслідок цього внутрішня енергія першого тіла збільшується, другого - зменшується, а їх температури вирівнюються.
Отже, можна говорити про дві форми передачі енергії від одних тіл до інших: у формі роботи і у формі теплоти. Енергія механічного руху може перетворюватись в енергію теплового руху і навпаки. При цих перетвореннях має бути дотримано закону збереження і перетворення енергії, чим, по суті, застосовним до термодинамічних процесів і є перший закон термодинаміки, який сформульований в результаті узагальнення багатовікових дослідних даних.
Допустимо, що деяка система (газ, що знаходиться в циліндрі під поршнем), маючи внутрішню енергію U1, отримала деяку кількість теплоти Q1 і, перейшовши в новий стан, що характеризує внутрішню енергію U2, виконала роботу А проти зовнішніх сил. Кількість теплоти вважається додатною, коли вона підводиться до системи, а робота - позитивною, коли система виконує її проти зовнішніх сил.
Дослід показує, шо відповідно до закону збереження енергії при довільному способі переходу системи з першого стану у другий зміна внутрішньої енергії DU = U2 - U1 дорівнюватиме різниці між кількістю теплоти Q, отриманою системою, і роботою А, яка виконана системою проти зовнішніх сил:
DU = Q - A, або Q = DU + A.
Це рівняння є математичним виразом першого закону термодинаміки:
теплота, надана системі, витрачається на збільшення її внутрішньої енергії і на виконання системою роботи проти зовнішніх сил.
Вираз для першого закону термодинаміки для малої зміни стану системи матиме вигляд: dQ = dU + dA або в коректнішій формі dQ = dU+ +dA, де dU - нескінченно мала зміна внутрішньої енергії системи, dА -нескінченно мала робота, dQ - нескінченно мала кількість теплоти. У цьому виразі dU є головним диференціалом, а dА і dQ такими не є.
Дуже важливим є випадок, коли система - це періодично діюча машина, в якій газ, пара або інше "робоче тіло" внаслідок деякого процесу повертається до початкового стану. У цьому разі DU = 0 і А = Q.
 Робота, шо виконується машиною за один цикл, дорівнює підведеній ззовні теплоті Q. Цей висновок дає змогу сформулювати перший закон термодинаміки так: неможливо побудувати періодично діючий двигун, який виконував би роботу без підведення енергії ззовні або виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний овигун першого роду неможливий).
Робота, шо виконується машиною за один цикл, дорівнює підведеній ззовні теплоті Q. Цей висновок дає змогу сформулювати перший закон термодинаміки так: неможливо побудувати періодично діючий двигун, який виконував би роботу без підведення енергії ззовні або виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний овигун першого роду неможливий).
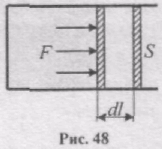
Знайдемо роботу, яка виконується газом при зміні його об'єму. Нехай газ знаходиться в циліндричній посудині з поршнем (рис. 48).
Якщо газ, розширюючись, переміщує поршень на нескінченно малу відстань dl, то він виконує над ним роботу
dA = Fdl = pSdl = pdV,
де S - площа поршня, Sdl = dV - зміна об'єму газу.
Повну роботу А, яка виконана газом при зміні його об'єму від V1 до V2, знайдемо інтегруванням:
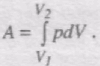
Результат інтегрування визначається характером залежності між тиском і об'ємом газу.
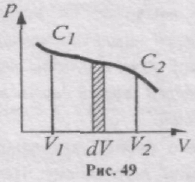 Зобразимо графічно залежність тиску від об'єму (рис. 49). При збільшенні об'єму на dV виконана газом робота дорівнює pdV, тобто вона числово дорівнює площі, яка заштрихована на рис. 49. Повна робота, що виконується газом при розширенні від об'єму V1 до V2, визначається площею, яка обмежена віссю абсцис, кривою p = f(V) і прямими V1 i V2.
Зобразимо графічно залежність тиску від об'єму (рис. 49). При збільшенні об'єму на dV виконана газом робота дорівнює pdV, тобто вона числово дорівнює площі, яка заштрихована на рис. 49. Повна робота, що виконується газом при розширенні від об'єму V1 до V2, визначається площею, яка обмежена віссю абсцис, кривою p = f(V) і прямими V1 i V2.
Величина роботи A залежить не тільки від початкового і кінцевого станів тіла, а й від того, яким є термодинамічний процес, тобто по якій кривій відбувається зміна стану.
106. Теплоємність. Класична молекулярно-кінетична теорія теплоємностей ідеального газу та її обмеженість.
Для характеристики теплових властивостей газу, як і будь-якого іншого тіла, користуються особливою величиною - теплоємністю.
Теплоємністю тіла називається фізична величина, яка числово дорівнює кількості теплоти, яку потрібно надати тілу, щоб підвищити його температуру на один кельвін:

Значення СТ залежить віл маси тіла, його хімічного складу, термодинамічного стану і виду процесу зміни стану тіла, в якому надходить теплота dQ.
Питомою теплоємністю c називається фізичпа величина, що числово дорівнює кількості теплоти, яку слід надати одиниці маси цієї речовини для підвищення її температури на 1К :
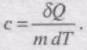
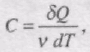 Молярною теплоємністю С називається фізична величина, яка числово дорівнює кількості теплоти, яку треба надати одному молю речовини для підвищення його температури на 1К :
Молярною теплоємністю С називається фізична величина, яка числово дорівнює кількості теплоти, яку треба надати одному молю речовини для підвищення його температури на 1К :
де
v = m/m - кількість молей газу.
Між молярною теплоємністю С і питомою теплоємністю с існує співвідношення: С = mс.
Оскільки величина теплоємності газу залежить від умов, при яких йому надається кількість теплоти, то розрізняють теплоємність при сталому об'ємі СV і теплоємність при сталому тиску CP. В першому випадку нагрівання газу відбувається при сталому об'ємі, а в другому - при сталому тиску.
Якщо нагрівають газ, то згідно з першим законом термодинаміки dQ = dU + dA,
а для одного моля газу
CdT = dUm + pdVm.
Якщо газ нагрівається при сталому об'ємі, то надана газу теплота йде лише на збільшення його внутрішньої енергії:
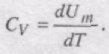
Якщо газ нагрівається при постійному тиску, то
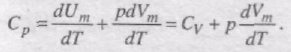

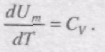 Тут враховано, що не залежить від виду процесу, оскільки внутрішня енергія ідеального газу не залежить ні від p, ні від V, а визначається лише температурою. Тому завжди
Тут враховано, що не залежить від виду процесу, оскільки внутрішня енергія ідеального газу не залежить ні від p, ні від V, а визначається лише температурою. Тому завжди
 Згідно з рівнянням Менделєєва - Клапейрона
Згідно з рівнянням Менделєєва - Клапейрона
В результаті
Сp = СV + R.
Отриманий вираз називається рівнянням Маєра. Воно вказує на те, що Ср завжди більше від СV на величину універсальної газової сталої. Це пояснюється тим, що під час нагрівання газу при сталому тиску потрібна додаткова кількість теплоти на виконання роботи розширення газу.
Оскільки dUm = i/2 RdT, то
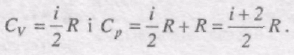
Отримані вирази для СV i Ср добре збігаються з експериментом для одноатомних і багатьох двоатомних газів при кімнатній температурі (Н2, N2, O2). Однак у Сl2 CV = 6/2 R, що неможливо пояснити. У триатомних газів спостерігаються систематичні відхилення від теорії.
Експеримент показав, що теплоємність залежить від температури. Водночас згідно з формулами для СV i Ср вона стала для даного газу.
Причина розбіжності теорії і експерименту для температурної залежності СV полягає в тому, що закон про рівномірний розподіл енергій між всіма ступенями вільності молекул не є правильним, а лише наближено застосовується для найпростіших газів, що перебувають при не дуже низьких температурах.
Лише квантова теорія дає змогу пояснити температурну залежність теплоємності.
107. Застосування першого закону термодинаміки до ізопроцесів
Ізопроцесами в газах називаються процеси, при яких один із основних параметрів стану (V, р, Т) зберігається постійним.
Ізохорний процес (V = соnst, m=соnst).
Діаграма цього процесу в координатах р, V зображається прямою, яка паралельна до осі ординат, де 1-2 - ізохорнне нагрівання, а 1-3 - ізохорне охолодження (рис. 50).
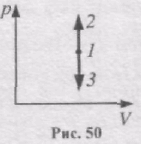 При iзохорному процесі газ не виконує роботи над зовнішніми тілами: dА = рdV = 0.
При iзохорному процесі газ не виконує роботи над зовнішніми тілами: dА = рdV = 0.
Отже, з першого закону термодинаміки dQ = dU+ +dA для ізохорного процесу випливає, що dQ = dU. Оскільки dUm = CVdT, то для довільної маси газу

 Ізобарний процес (р = соnst, m = const).
Ізобарний процес (р = соnst, m = const).
Діаграма цього процесу в координатах р,V зображається прямою, яка паралельна до осі V (рис. 51), де 1-2 - ізобарний процес розширення. 1-3 - ізобарний стиск.
 Робота, яку виконує газ при ізобарному розширенні від об'єму V1 до V2, дорівнює
Робота, яку виконує газ при ізобарному розширенні від об'єму V1 до V2, дорівнює
де використано рівняння Менделєєва - Клапeйрона.
При ізобарному процесі при наданні газу масою m кількості теплоти
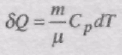
його внутрішня енергія зростає на величину

 Газ виконує роботу
Газ виконує роботу
Ізотермічний процес (Т = соnst, m = соnst).
 Діаграма цього процесу в координатах р, V є гіперболою. 1-3 -ізотермічний стиск, 1-2 - ізотермічне розширення (рис. 52).
Діаграма цього процесу в координатах р, V є гіперболою. 1-3 -ізотермічний стиск, 1-2 - ізотермічне розширення (рис. 52).
Робота газу при ізотермічному розширенні:
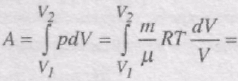

При Т = соnst внутрішня енергія ідеального газу не змінюється, тобто

 тобто вся кількість теплоти, надана газу, витрачається на виконання ним роботи проти зовнішніх сил:
тобто вся кількість теплоти, надана газу, витрачається на виконання ним роботи проти зовнішніх сил:
Робота розширення газу (V2 > V1) додатна. У випадку стиску газу (процес 1-3) робота А, що виконується газом, від'ємна, водночас зовнішні сили виконують додатну роботу А' = -А. При цьому Q < 0, тобто теплота від газу відводиться.
108. Адіабатний процес. Застосування першого закону термодинаміки до адіабатного процесу ідеального газу
Адіабатний - це такий процес, який відбувається без обміну теплотою (dQ = 0) між термодинамічною системою і середовищем.
Розглянемо, при яких умовах можна реально здійснити адіабатний процес. Можливо в трьох випадках здійснити процес, який буде адіабатним.
В першому випадку необхідна адіабатна оболонка, теплопровідність якої дорівнює нулю. Такою оболонкою може служити посудина Дьюара. В такій посудині з подвійними посрібленими стінками, з простору між якими відкачано повітря, передачі теплоти через стінки практично не буде.
Другий випадок адіабатичних процесів - це процеси, що відбуваються дуже швидко. При швидкому стиску газу затрачається робота dА, внаслідок чого збільшується внутрішня енергія dU, що викликає підвищення температури. При підвищенні температури деяка кількість теплоти dQ повинна бути передана навколишньому середовищі, що знаходиться при нижчій температурі, але процес теплопередачі вимагає деякого часу, тому при швидкому стиску теплота не встигає поширитись з даного об'єму.
Третій випадок - це процеси, що відбуваються в дуже великих об'ємах газу, наприклад, в атмосфері. Якщо в атмосфері відбудеться зменшення тиску - розрідження, яке виникає внаслідок атмосферної діяльності, то кількість теплоти, яка повинна бути передана із навколишнього простору для того, щоб вирівняти температуру, яка понизилась внаслідок адіабатичного розширення, просто не встигне поширитися упродовж значного проміжку часу.
Перший закон термодиниміки у випадку адіабатичного процесу має такий вигляд:

Продиференціювавши рівняння Менделєєва - Клапейрона, знайдемо вираз для dТ:

де R = Ср - СV.
 Підставивши значення dT у вираз першого закону термодинаміки, отримаємо
Підставивши значення dT у вираз першого закону термодинаміки, отримаємо

де - показник адіабати, або коефіцієнт Пуассона.
Проінтегруємо отриманий вираз:

рVg = соnst або p1Vg1 = p2Vg2.
Цей иираз називається рівнянням Пуассона.
Побудуємо графіки рівнянь:
1) рVg = соnst (адіабата);
2) рV = соnst (ізотерма) (рис. 53).

 Диференціюючи рівняння рV=соnst, отримуємо pdV + Vdp = 0, звідси для ізотерми маємо
Диференціюючи рівняння рV=соnst, отримуємо pdV + Vdp = 0, звідси для ізотерми маємо
Диференціюючи рівняння рVg = соnst,
маємо рgVg-1dV + Vgdp = 0.
 Звідси
Звідси
Отже, тангенс кута нахилу адіабати в g разів більший, ніж в ізотерми. Це пояснюсгься тим, що при адіабатному стиску 1-3 тиск газу збільшується не лише внаслідок зменшення його об'єму, як при ізотермічному стиску, але і підвищенням температури. При адіабатному розширенні газу 1-2 його температура знижується і тому тиск зменшується швидше ніж при iзотермічному розширенні.
Розрахуємо роботу, яку виконує газ при адіабатному процесі 1-2. Вона вимірюється числово площею, заштрихованою на рис. 53. Якщо газ адіабатно розширюється від об'єму V1 до V2, то його температура зменшується від Т1 до Т2 і робота розширення iдеального газу

Оскільки.

 тому
тому
Якшо використати рівняння адіабатного процесу у змінних T, V i T, p, отримуємо

Тоді роботу газу при адіабатному процесі можна записати в такому вигляді:
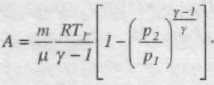

Робота, яка виконується газом при адіабатному розширенні 1-2, менша, ніж при ізотермічному. Це пояснюється тим, що при адіабатичному розширенні відбувається охолодження газу, тоді як при ізотермічному - температура підтримується постійною за рахунок припливу ззовні еквівалентної кількості теплоти.
109. Коловий процес. Теплові двигуни і холодильні машини. Оборотні і необоротні процеси
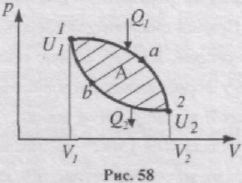 Коловим процесом (циклом) називається процес, при якому система, пройшовши через ряд станів, повертається у вихідний стан. На діаграмі процесів цикл зображається замкненою кривою.
Коловим процесом (циклом) називається процес, при якому система, пройшовши через ряд станів, повертається у вихідний стан. На діаграмі процесів цикл зображається замкненою кривою.
Тіло, яке здійснює коловий процес і обмінюється енергією з іншими тілами, називається робочим тілом. Звичайно таким тілом є газ.
Цикл, який виконує ідеальний газ, можна розбити на процеси розширення (1-2) і стискання (2-1) газу (рис. 58). Робота розширення. яка визначається площею фігури 1а2V2V11, додатнa (dV > 0), робота стискування, що визначається площею фігури 2b1V1V22, від'ємна (dV<0). Робота, яка виконується газом за цикл
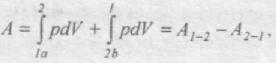
визначається заштрихованою площею, що охоплюється кривою 1a2b1.
Якщо за цикл виконується додатна робота А>0 (цикл виконується за годинниковою стрілкою), то він називається прямим. При прямому циклі робочому тілу, надається кількість теплоти Q1 і тіло виконує роботу розширення А1-2 . Внутрішня енергія змінюється на величину DU=U2 - U1 , де U1 i U2 - внутрішня енергія тіла в стані 1 і 2, відповідно. Потім тіло стискається, над ним виконується робота А'2-1 = -A2-1 , яка менша, ніж А1-2 , і від нього забирається кількість теплоти Q2 , яка менша Q1. Внутрішня енергія змінюється на величину - DU. Робота стискування виконується за рахунок використання частини роботи виконаної при розширенні робочого тіла, наприклад, за рахунок кінетичної енергії маховика, що почав обертатись при розширенні робочого тіла. За першим законом термодинаміки для процесу розширення Q1 = DU + A1-2, для процесу стискання:-Q2 = -DU - A2-1.
Якщо ці рівняння додати, то отримаємо Q1 - Q2 = A1-2 - A2-1 = A.
Після закінчення циклу тіло повертається в свій початковий стан, внутрішня енергія тіла не змінюється. Тому робота циклу може виконуватись лише за рахунок зовнішніх джерел, що підводять до тіла теплоту.
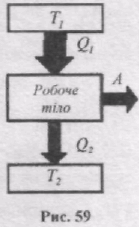 Прямий цикл використовується в тепловому двигуні, в якому робоче тіло отримує енергію у формі теплоти від зовнішніх джерел і частину її віддає у формі роботи. Тепловий двигун складається з трьох частин: нагрівник, робоче тіло, холодильник (рис. 59). Від термостата з вищою температурою Т1, який називається нагрівником, за цикл відбирається кількість теплоти Q1, а термостату з нижчою температурою Т2, який називається холодильником, за цикл передається кількість теплоти Q2 і виконується робота А = Q1 - Q2.
Прямий цикл використовується в тепловому двигуні, в якому робоче тіло отримує енергію у формі теплоти від зовнішніх джерел і частину її віддає у формі роботи. Тепловий двигун складається з трьох частин: нагрівник, робоче тіло, холодильник (рис. 59). Від термостата з вищою температурою Т1, який називається нагрівником, за цикл відбирається кількість теплоти Q1, а термостату з нижчою температурою Т2, який називається холодильником, за цикл передається кількість теплоти Q2 і виконується робота А = Q1 - Q2.
Тепловий двигун характеризується коефіцієнтом корисної дії h, який дорівнює відношенню роботи А, яка виконана тілом за цикл роботи, до кількості теплоти Q1, що отримало тіло від нагрівника:
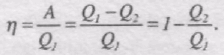
 Температура газу при його стискуванні повинна бути нижча, ніж при розширенні. Тоді тиск газу у всіх проміжних станах при стиску буде менший, ніж при розширенні, і буде виконано умову А1-2>А2-1, необхідну при виконанні двигуном корисної роботи.
Температура газу при його стискуванні повинна бути нижча, ніж при розширенні. Тоді тиск газу у всіх проміжних станах при стиску буде менший, ніж при розширенні, і буде виконано умову А1-2>А2-1, необхідну при виконанні двигуном корисної роботи.
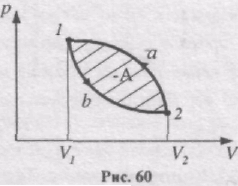
Якщо здійснити цикл проти годинникової стрілки, то робота буде та сама за абсолютною величиною, але від'ємна (рис. 60):
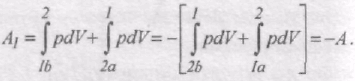
 Такий процес називається зворотним. Зворотний цикл використовується в холодильних машинах - періодично діючих установках, в яких за рахунок роботи зовнішніх сил теплота переноситься до тіла з вищою температурою (рис. 61). Така машина забирає за цикл від тіла з температурою Т2, кількість теплоти Q2 і віддає тілу при температурі Т1, кількість теплоти Q1. Над машиною за цикл повинна бути виконана робота A. Кількість відданої теплоти Q1 дорівнює сумі отриманої кількості теплоти Q2 і роботи, яку виконали зовнішні сили:
Такий процес називається зворотним. Зворотний цикл використовується в холодильних машинах - періодично діючих установках, в яких за рахунок роботи зовнішніх сил теплота переноситься до тіла з вищою температурою (рис. 61). Така машина забирає за цикл від тіла з температурою Т2, кількість теплоти Q2 і віддає тілу при температурі Т1, кількість теплоти Q1. Над машиною за цикл повинна бути виконана робота A. Кількість відданої теплоти Q1 дорівнює сумі отриманої кількості теплоти Q2 і роботи, яку виконали зовнішні сили:
Q1 = Q2 +A.
Отже, чистий результат циклу полягає в тому, що тіло з меншою температурою, від якого забирається певна кількість теплоти, охолоджується, а тіло з вищою температурою, якому віддається теплота, нагрівається.
Ефективність холодильної машини характеризуеться її холодильним коефіцієнтом, який дорівнює відношенню віднятої кількості теплоти Q2 до роботи, яка затрачається на приведення машини в роботу:

Робочим тілом в холодильній машині слугують пари рідин, які легко киплять: аміак, фреон і ін. Енергія підводиться до машини від електричної мережі. За рахунок цієї енергії відбувається перехід теплоти від холодильної камери до більш нагрітого тіла - до навколишнього середовища.
Оборотним термодинамічним процесом називається така зміна стану системи, яка, будучи проведена у зворотному напрямку, повертає її в початковий стан так, щоб система пройшла через ті самі проміжні стани, що і у прямому процесі, але у зворотній послідовності, а стан тіл поза системою залишився незмінним.
Необоротним називається процес, коли зворотний перехід через ті самі проміжні стани неможливий.
Будь-який рівноважний процес є оборотним.
Оборотні процеси - це до деякої міри ідеалізація реальних процесів. Всі реальні процеси є необоротними.
110. Цикл Карно і його коефіцієнт корисної дії для ідеального газу
Цикл Карно – це цикл ідеальної теплової машини. В ній відсутні втрати на теплопровідність, теплове випромінювання, тертя і т.п.
Цикл Карно встановлює основні співвідношення процесу переходу теплоти від одного тіла до іншого з перетворенням цієї теплоти.
Розглянемо коловий процес, в результаті якого тепло, відняте від якогось тіла, можна перетворити в роботу і притому якнайкраще.
Карно довів теорему: із всіх періодично діючих теплових машин, що мають однакові температури нагрівачів і холодильників, найбільший ККД мають оборотні машини: при цьому ККД оборотних машин, що працюють при однакових температурах нагрівачів і холодильників, дорівнюють один одному і не залежать від конструкції машини.
Цикл Карно складається з двох ізотерм і двох адіабат .
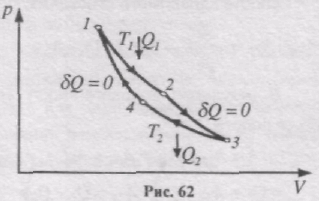 Ізотермічне розширення і стиск задані, відповідно, кривими 1-2 і 3-4, адіабатне розширення і стиск-, відповідно, кривими 2-3 і 4-1. Для виконання циклу Карно необхідні термостат з температурою Т1 (нагрівник) і термостат з температурою Т2 (холодильник), причому Т1>Т2. При проходженні адіабатних ділянок циклу система повинна бути термоізольованою від навколишнього середовища.
Ізотермічне розширення і стиск задані, відповідно, кривими 1-2 і 3-4, адіабатне розширення і стиск-, відповідно, кривими 2-3 і 4-1. Для виконання циклу Карно необхідні термостат з температурою Т1 (нагрівник) і термостат з температурою Т2 (холодильник), причому Т1>Т2. При проходженні адіабатних ділянок циклу система повинна бути термоізольованою від навколишнього середовища.
Визначимо ККД циклу Карно. При ізотермічному процесі DU=0 і робота розширення газу А12 дорівнює кількості теплоти Q1, що отримав газ від нагрівника:
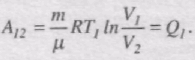
При адіабатному розширенні робота виконується за рахунок зміни внутрішньої енергії:
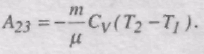
При ізотермічному стисканні газу виконується робота А34 і газ віддає холодильнику кількість теплоти Q2:
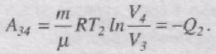
Робота адіабатного стискання:

В результаті колового циклу виконується робота
А = А12 + А23 + А34 + А41 = Q1 + A23 - Q2 - A23 = Q1 - Q2.
Термічний ККД циклу Карно

Використаємо рівняння адіабат 2-3 і 4-1:
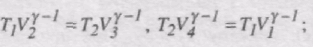

Звідси
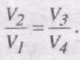
Тоді,



і
Для циклу Карно ККД визначається лише температурами нагрівника і холодильника.
Лекція №41
111. Другий закон термодинаміки
Другий закон термодинаміки встановлює напрямок перебігу і характер процесів, що відбуваються в природі.
Згідно із Клаузіусом, який дав одне з перших формулювань другого закона, теплота ніколи не може переходити сама собою від тіл з нижчою температурою до тіл з вищою температурою.
Це означає, що для такого переходу: теплоти потрібна затрата роботи зовнішнього джерела, що здійснюється в холодильній машині.
Фізичний зміст другого закону найбільш зрозуміло розкриваєгься у формулюванні Планка: неможливо побудувати таку періодично діючу теплову машину, яка, отримавши ззовні деяку кількість теплоти при довільній температурі, цілком перетворювала би її в механічну роботу і при цьому поверталась би точно у вихідний стан.
Отже, в довільній тепловій машині перетворюється в роботу лише частина отриманої від нагрівника кількість теплоти, тобто A = Q1 - Q2. Теплота Q2 не використовується в машині і розсіюється в навколишньому середовищі. Величина Q2 завжди досить велика, тому коефіцієнт корисної дії теплової машини h =Q1 - Q2/Q1 завжди значно менший від одиниці.
Із формули ККД теплової машини, яка працює за циклом Карно,
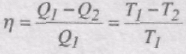
випливає, що Q2 дорівнювала би нулеві лише в тому випадку, якби температуру робочого тіла можна було би довести до температури абсолютного нуля, яку повинен мати холодильник. ККД реальних теплових машин завжди менший від одиниці.
Вираз для ККД теплової машини, яка працює за циклом Карно, теж є одним з формулювань другого закону:
коефіцієнт корисної дії ідеальної теплової машини визначається лише температурами нагрівника і холодильника.
Кельвін сформулював другий закон термодинаміки в такому вигляді:
неможливо побудувати теплову машину, яка перетворювала би в роботу теплоту найбільш холодного з тіл, що є в системі.
Другий закон термодинаміки вказуе на необоротність процесу перетворення однієї форми передачі енергії - роботи - у другу форму передачі енергії - теплоту. Він стверджує, що процес переходу впорядкованого руху тіла як цілого в невпорядкований рух його частинок є необоротним. Упорядкований рух може переходити в неупорядкований без будь-яких додаткових процесів, як це відбувається, наприклад, при внутрішньому терті. Перехід же невпорядкованого руху частинок у впорядкований рух тіл можливий лише при умові, що він супроводжується будь-яким компенсуючим процесом.
У тепловій машині, що працює за прямим циклом, виконується робота за рахунок підведеної від нагрівника теплоти. Але при цьому частина отриманої теплоти передається холодильнику. Отже, робота за цикл не еквівалентна до підведеної теплоти.
У холодильній машині теплота передається віл холодного тіла до гарячого. Проте для здійснення такого процесу необхідний компенсуючий процес виконання роботи зовнішніми силами.
112. Ентропія. Ентропія ідеального газу
Формулу коефіцієнта корисної дії ідеальної теплової машини, що працює за циклом Карно

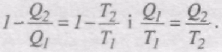 приведемо до вигляду
приведемо до вигляду
Відношення кількості переданої теплоти до температури тепловіддавача або теплоприймача Q/T називається зведеною кількістю теплоти.
Під час виконання циклу Карно приведені теплоти при процесах ізотермічного розширення і стиску однакові.
У випадку необоротної теплової машини

 і
і
Тоді, об'єднавши формули для оборотної і необоротної теплових машин, маємо:
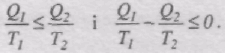
Умовимося кількість теплоти, яка віддана тілу нагрівником, вважати додатною, а кількість теплоти, віддану тілом холодильнику, - від'ємною. Тоді
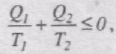
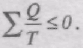 причому "=" відповідає оборотним переходам, а "<" - необоротним.
причому "=" відповідає оборотним переходам, а "<" - необоротним.
В загальному вигляді
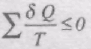 При неперервній зміні стану тіла можна вважати, що воно входить у теплообмін з неперервним рядом нагрівників і холодильників. Кожен з цих нагрівників і холодильників віддає робочому тілу або отримує від нього нескінченно малі кількості теплоти dQ. Тоді сума
При неперервній зміні стану тіла можна вважати, що воно входить у теплообмін з неперервним рядом нагрівників і холодильників. Кожен з цих нагрівників і холодильників віддає робочому тілу або отримує від нього нескінченно малі кількості теплоти dQ. Тоді сума
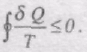 перетворюється в інтеграл
перетворюється в інтеграл
Це співвідношення називається рівністю (нерівністю) Клаузіуса.
 Розглянемо оборотний цикл 1аnb1 . Запишемо рівність Клаузіуса у вигляді суми двох інтегралів:
Розглянемо оборотний цикл 1аnb1 . Запишемо рівність Клаузіуса у вигляді суми двох інтегралів:

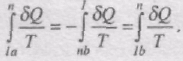
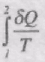 Звідси,
Звідси,
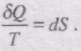 Незалежність інтегралу від шляху оборотного переходу між станами 1 і 2 означає, що цей інтеграл виражає зміну деякої функції стану тіла. Підінтегральний вираз dQ/T є повним диференціалом деякої функції, яка визначається лише станом системи і не залежить від шляху, яким система прийшла в цей стан. Отже,
Незалежність інтегралу від шляху оборотного переходу між станами 1 і 2 означає, що цей інтеграл виражає зміну деякої функції стану тіла. Підінтегральний вираз dQ/T є повним диференціалом деякої функції, яка визначається лише станом системи і не залежить від шляху, яким система прийшла в цей стан. Отже,
Функція стану, диференціал якої є dQ/T , називається ентропією S.
 Згідно з визначенням зміна енторопії при оборотному процесі
Згідно з визначенням зміна енторопії при оборотному процесі
де підінтегральний вираз і границі інтегрування треба виразити через величини, що характеризують досліджуваний процес. Ця формула визначає ентропію лише з точністю до адитивної сталої, тобто початок відліку ентропії довільний.
Кожний стан тіла характеризується певним значенням ентропії S, яка є повним диференціалом.
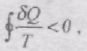 Розглянемо цикл 1anb1, частина якого 1an необоротна, вона здійснюється нерівноважним процесом, а частина nb1 оборотна, виконується рівноважним процесом.
Розглянемо цикл 1anb1, частина якого 1an необоротна, вона здійснюється нерівноважним процесом, а частина nb1 оборотна, виконується рівноважним процесом.
Тоді на основі


тобто інтеграл від по необоротному шляху завжди менший від інтеграла по оборотному шляху між тими ж станами.
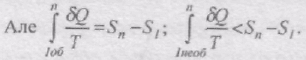
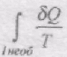
При необоротному процесі менший від зміни ентропії в даному процесі.

Тоді
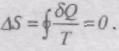 Для оборотного рівноважного циклу зміна ентропії
Для оборотного рівноважного циклу зміна ентропії
Якщо система виконує необоротний цикл, то ентропія системи зростає: DS > 0.
Ентропія замкненої системи може або зростати, або залишатися постійною.
Оскільки реальні процеси необоротні, то всі процеси в замкненій системі ведуть до збільшення її ентропії - у цьому полягає принцип зростання ентропії. Цей принцип лежить в основі формулювання другого закону термодинаміки: можливі лише такі процеси, що відбуваються в макроскопічній системі, які ведуть до збільшення її ентропії.
Знайдемо зміну ентропії у процесах ідеального газу. Оскільки
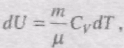
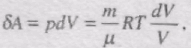
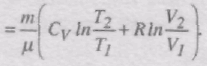
 то
то

Зміна ентропії DS1à2 ідеального газу при переході його із стану 1 у стан 2 не залежить від виду процесу переходу 1à2.
При адіабатному процесі dQ = 0 і DS ³ 0.
Для оборотного адіабатного процесу зміна ентропії дорівнює 0, для необоротного S2 >S1 - ентропія тіла зростає.
Оборотний адіабатний процес - ізоентропічний процес.
При ізотермічному процесі T1 = T2 і DS = m/mRlnV2/V1, при ізохоричному процесі V1 = V2 і DS = m/mCVlnT2/T1.
113. Теорема Нернста та її наслідки
У 1906р. термодинаміка збагатилась новим фундаментальним законом, відкритим Нернстом емпіричним шляхом. Цей закон одержав назву теплової теореми Нернста (третій початок термодинаміки)
Зміст теореми Нернста зводиться до двох тверджень:
І. При наближенні до абсолютного нуля ентропія термодинамічної системи прямує до певної конечної межі.
ІІ. Теорема Нернста стверджує, що усі процеси при абсолютному нулі температури, які переводять систему з одного рівноважного стану в інший рівноважний стан, відбуваються без зміни ентропії.
Таким чином теорема Нернста заперечує можливість досягнути температури абсолютного нуля, оскільки всі процеси, які протікають з теплопередачею, супроводжуються зміною ентропії. Це означає, що при S=const процес теплопередачі неможливий,тобто при Т=0 система більше не віддає теплоту, тобто не охолоджується.
Можна сформулювати таке положення:
Не можна досягнути абсолютного нуля температури, відбираючи у тіла теплоту за допомогою кінцевих реальних процесів.
Або, не можна створити машину, яка здатна забрати усю теплоту від тіла, охолодивши його до абсолютного нуля.
Змістовний модуль 9
Читайте також:
- V Процес інтеріоризації забезпечують механізми ідентифікації, відчуження та порівняння.
- VІI. Утворіть вищий та найвищий ступені порівняння від прислівників із вправи VI.
- А .Маршалл - основоположник неокласичної теорії.
- Аксіоматичний метод у математиці та суть аксіоматичної побудови теорії.
- Альтернативні теорії вартості
- Альтернативні теорії вартості
- Альтернативні теорії вартості
- Альтернативні теорії вартості
- Альтернативні теорії вартості
- Альтернативні теорії капіталу
- Альтернативні теорії макроекономічного регулювання
- Альтернативні теорії максимізації
| <== попередня сторінка | | | наступна сторінка ==> |
| VІII. Основи молекулярної фізики і термодинаміки | | | ІХ. Фізика твердого тіла |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |