
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лужні та лужно-земельні метали
До лужних металів відносять: Li, Na, K, Rb, Cs, Fr. До лужно-земельних Ca, Sr, Ba, Ra (Be i Mg не відносять до лужноземельних металів). Ступені окиснення для лужних +1, для лужноземельних +2.
Ці метали є активними металами. Активність лужних металів перевищує активність лужно-земельних (стоять лівіше в періодичній системі). Найбільш активні з лужних металів – цезій та францій (радіоактивний).
Лужні та лужноземельні метали реагують з більшістю неметалів. Під час реакції з киснем або киснем повітря утворюються оксиди, пероксиди або супероксиди цих металів:
4Li+O2=2Li2O(оксид); 2Na+O2=Na2O2(пероксид);
К+О2 =КО2 (супероксид).
Пероксиди та супероксиди лужних металів використовуються в засобах індивідуального захисту органів дихання. Вони поглинають вуглекислий газ і воду і виділяють кисень за реакціями:
Na2O2 + CO2 = Na2CO3 + 0,5O2; 2NaO2 + CO2 = Na2CO3 + 1,5O2.
Na2O2 + Н2О = 2NaOН + 0,5O2; 2NaO2 + Н2О = 2NaOН + 1,5O2.
При контакті з повітрям рубідій та цезій самозаймаються в компактному стані, інші у вигляді порошків. Волога сприяє самозайманню, отже, у вологому повітрі горіння виникає легше і скоріше, ніж у сухому.
Літій за звичайних умов реагує з азотом з утворенням нітриду літію:
6Li + N2 = 2Li3 N
Під час нагрівання з воднем лужні та лужно-земельні метали утворюють гідриди:
2 Na + H2 = 2 NaH; Ca + H2 = CaH2.
В гідридах гідроген має ступінь окиснення –1. Гідриди пожежонебезпечні речовини, вони, як і самі лужні та лужноземельні метали, бурхливо реагують з водою:
CaH2 +2Н2О = Са(ОН)2 + 2Н2
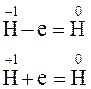
Водень, що виділяється під час реакції, займається. В разі взаємодії великої кількості гідриду та води може статися вибух.
Особливу увагу фахівцям з пожежної безпеки треба привернути до того факту, що лужні та лужноземельні метали інтенсивно реагують з водою. При цьому, в залежності від активності металу, водень може: виділятися відносно спокійно (Li, лужно-земельні метали), займатися (Na, K), або вибухати (Rb, Cs).
2Na + 2Н2О = 2NaОН + Н2.
Звідси випливає правило: при гасінні приміщень, в яких знаходяться лужні та лужно-земельні метали, не можна використовувати воду.
Ще більш інтенсивно, ніж з водою, лужні та лужно-земельні метали реагують з кислотами:
2К + 2НСl = 2KCl + H2.
Лужні та лужно-земельні метали відновлюють менш активні метали з їх оксидів:
ТіО2 + 4 Na = Ті + 2Na2О.
Гідроксиди лужних та лужноземельних металів – є сильними основами, їх називають “лугами”.
Зі сполук лужних та лужноземельних металів найчастіше використовуються такі: хлорид натрію (NaСl) – кухонна сіль, гідрогенкарбонат натрію (стара назва натрій бікарбонат) – NaHCO3 – питна сода, Na2CO3 – кальцинована сода, NaОН – каустична сода, К2CO3 – поташ. Сполуки калію (сульфат, хлорид, нітрат) широко застосовуються як калійні добрива. Нітрати та перхлорати цих металів використовуються як окисники у твердих ракетних паливах та сумішевих вибухових речовинах.
Сполуки кальцію широко застосовуються в будівництві: СаСО3 – крейда, вапняк, мармур; СаО – вапно; СаSO4 · 0,5Н2О – гіпс. Будівельний гіпс є повітряною в’яжучою речовиною, яку одержують за допомогою термообробки гіпсового каменю при 110-180оС:
СаSO4 · 2Н2О ® СаSO4 · 0,5Н2О + 1,5Н2О.
При змішуванні будівельного гіпсу з достатньою кількістю води утворюється пластичне тісто, яке починає швидко густіти і твердіти, завдяки реакції, зворотної до процесу гідратації.
СаSO4 · 0,5Н2О + 1,5Н2О ® СаSO4 · 2Н2О.
Сполуки лужних та лужноземельних металів використовуються в пожежній справі. NaHCO3 – є основою вогнегасного порошку ПСБ–3; Na2CO3 – входить до складу вогнегасного порошку ПС; суміш NaCl i KCl – основні компоненти порошку ПГС–М; NaHCO3 є також одним з компонентів газоутворюючої суміші в хімічно-пінних вогнегасниках. В таких вогнегасниках відбуваються такі реакції:
NaHCO3 + H2SO4 ® NaHSO4 + H2O + CO2,
6NaHCO3 + Al2(SO4)3 ® 3Na2SO4 + 2Al(OH)3 + 6CO2.
В пожежній справі також використовуються деякі луги як адсорбенти вуглекислого газу в протигазах (хімічні поглиначі вапняні). В них відбуваються реакції:
Са(ОН)2 + СО2 =СаСО3¯ + Н2О, 2NaOH + CO2 = Na2CO3 + H2O.
Читайте також:
- Банківські метали
- Важкі конструкційні метали. Хімічні властивості заліза.
- Важкі метали
- Гідрокарбонати, карбонати, лужність
- Легкі конструкційні метали (Be, Mg, Al, Ti )
- Лекція №5. Металевий тип зв’язку. Властивості металевих кристалів. Метали в наближенні вільних електронів
- Лужні метали, їх характеристика.
- Лужноземельні метали
- Неметали як прості речовини
- Розподіл електронів по енергетичних зонах. Валентна зона і зона провідності. Метали, діелектрики і напівпровідники
- Яким методом не можна виявити метали, що входять до складу оболонки кулі, досліджуючи ділянку пояска обтирання?
| <== попередня сторінка | | | наступна сторінка ==> |
| Методи одержання металів | | | Легкі конструкційні метали (Be, Mg, Al, Ti ) |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |