
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція №5. Металевий тип зв’язку. Властивості металевих кристалів. Метали в наближенні вільних електронів
Попередньо розглянуті нами типи зв’язку в кристалах реалізуються тоді, коли всі електрони розподілені по замкнутих електронних оболонках, локалізованих поблизу ядер. Електронна густина між ядрами незначна. Тоді взаємодію між іонами можна розглядати як взаємодію між зарядженими сферами, скориставшись для цього законами класичної фізики.
Однак для багатьох кристалів густина електронів у міжіонному просторі доволі велика і розраховувати зв’язки у таких кристалах за вище наведеними схемами не можна. Для таких кристалів поведінка електронів дуже важлива, тому необхідно враховувати електрон-електронну та електрон-іонну взаємодії. Метали належать саме до таких кристалів.
Найпростішу модель металу можна уявити собі як іонний каркас з періодично розміщених позитивно заряджених іонів (іонних остовів), який помістили у однорідний від’ємнозаряджений «газ», що складається з вільних електронів.
Колективізація (усуспільнення) валентних електронів власне і визначатиме властивості металевих кристалів. Справді, металевий зв’язок, утворений таким чином, є сферично симетричним, а отже ненаправленим. Для нього характерними будуть високі координаційні числа та щільне пакування часток, малі коефіцієнти стисливості та теплового розширення. Вільні електрони визначатимуть високу електро- та теплопровідності. Для металів характерними є висока відбивна здатність та непрозорість для електромагнітних хвиль від найнижчих частот до далекої ультрафіолетової області.
Переважна більшість металів має структури типу міді (ГЦК), магнію (гексагональна щільноупакована, ГЩУ) та вольфраму (ОЦК). Механічні властивості металів дуже різні і сильно залежать від типу кристалічної структури. Так ГЦК мідь – один із найпластичніших матеріалів, який при кімнатних температурах можна розкатати у фольгу мікронних розмірів. А гексагональний берилій – крихкий метал, пластини якого товщиною 1- 2 мм можна легко зламати одним порухом руки.
Енергію зв’язку металевих кристалів можна розрахувати методом Евальда.
 , (10)
, (10)
де 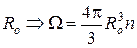 , де n- число атомів в елементарній комірці.
, де n- число атомів в елементарній комірці.
Розрахунки, проведені за цією формулою для лужних металів дають значення енергії які відрізняються від експериментальних на 10-20%, а для Ве та Мg відрізняються в 4-5 разів.
Як бачимо, теорія не може точно описати енергію взаємодії в металевих кристалах.
Спробуємо розглянути на базі цієї моделі інші властивості металів: електропровідність, ефект Холла, електронну теплоємність, як це зробив Друде у 1900 році.
Електропровідність. На електрони в Ме, який знаходиться в полі Е, діє сила F= -eE , е- заряд електрона (візьмемо його додатнім і поставимо знак «–»).
Тоді прискорення, з яким буде рухатись електрон
 (11)
(11)
Оскільки початкова (до початку дії поля) швидкість може бути будь-якою (рух електронів хаотичний) як за напрямком, та і за величиною, то середнє значення початкової швидкості = 0. В результаті середнє значення швидкості електрона в зовнішньому електричному полі:
 (12)
(12)
Якщо в одиниці об’єму є n електронів, то густина струму
 , (13)
, (13)
або електропровідність  , або середній час руху електрона
, або середній час руху електрона  .
.
Тоді середня довжина вільного пробігу електрона  .
.
В теорії Друде електрони підпорядковуються законам класичної статистики (ідеальний газ електронів). Нагадаємо, що Друде вважав, що електрони в Ме взаємодіють тільки з іонними остовами, а в проміжках між зіткненнями не взаємодіють один з одним. Теплова рівновага настає за рахунок зіткнення електронів з іонами. Тому при тепловій рівновазі середньоквадратична швидкість  .
.
Врахувавши останнє співвідношення запишемо питому провідність:
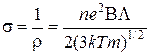 . (14)
. (14)
Розрахунки проведені за цими формулами дають τ= 1-20·10-14 с, vсер = 105 м/с, Λ = 1-10 ·10-10 м при Т = 77 К значення, які видались дослідникам достатньо достовірними.
Явним недоліком теорії Друде було те, що електропровідність виражають через час релаксації, для теоретичної оцінки якого не було ніяких теоретичних уявлень. Тому для доведення коректності моделі Друде необхідні були характеристики, які б не залежали від часу релаксації. До таких характеристик належить коефіцієнт Холла.
Ефект Холла. Схема експерименту проста: поле Ех викликає електричний струм jx . Одночасно до провідника прикладають поле Н||Z . В результаті на електрон діє сила Лоренца
 , (15)
, (15)
де е – заряд електрона, с – швидкість світла у вакуумі, v – швидкість електрона, яку він набув під дією поля, Н –вектор напруженості магнітного поля. Ця сила відхиляє електрони у напрямку осі –y. А оскільки у цьому напрямку провідник не замкнутий, то електрони накопичуються на границі провідника, створюючи електричне поле Еу, яке буде протидіяти накопичуванню заряду. У рівноважному стані дія цього поля повністю компенсує силу Лоренца, тому воно буде пропорційним до Н і струму jx у провіднику:
 , (16)
, (16)
де  - коефіцієнт Холла.
- коефіцієнт Холла.
Цей коефіцієнт можна знайти із співвідношення, що описує рух електрона під дією електричного та магнітного полів:
 , (17)
, (17)
де  - сила Ньютона,
- сила Ньютона,  - своєрідна сила опору. В стаціонарному стані це рівняння перепишеться в координатних осях XYZ
- своєрідна сила опору. В стаціонарному стані це рівняння перепишеться в координатних осях XYZ
 .
.
 (18)
(18)
У нашому випадку Нz=Н, тому замінимо  і помножимо вираз на
і помножимо вираз на 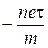 . Тоді ( 18) перетвореться у
. Тоді ( 18) перетвореться у
 (19)
(19)
Поле Еу знайдемо з умови jу = 0. . Отже коефіцієнт Холла дорівнює
. Отже коефіцієнт Холла дорівнює 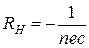 . Як бачимо коефіцієнт Холла залежить лише від концентрації носіїв. Концентрація носіїв у свою чергу визначатиметься валентністю металів n’ і в розрахунку на один атом повинна була б співпадати з нею. В експериментах з різними металами визначали електрорушійну силу Холла Еу і за нею визначали n’. Виявилось що ця величина для лужних металів складає 1,1-1,3; для Ве та магнію -0,2 – - 0,4, а для тривалентних Al та In – - 0,3. Отже, теорія Друде не може пояснити, чому це так. Ця теорія не могла пояснити і додатній знак константи Холла, який спостерігався у деяких елементів, і залежність константи Холла від величини Н, і залежність електронної теплоємності від температури. Справді, вільні електрони підпорядковуються класичній теорії, а отже, на кожну ступінь вільності електрона припадає 1/2kТ енергії . Тоді електронна теплоємність Сv=dU/dT=3/2k, не повинна залежати від температури, хоча експеримент показує, що температурна залежність Сv(T) існує. Більше того, пізніші експерименти по визначенню електропровідності високо чистих металів показали, що σ в них набуває таких значень, що розраховане за теорією Друде значення Λ може бути ~ 1 см, що є нереальним.
. Як бачимо коефіцієнт Холла залежить лише від концентрації носіїв. Концентрація носіїв у свою чергу визначатиметься валентністю металів n’ і в розрахунку на один атом повинна була б співпадати з нею. В експериментах з різними металами визначали електрорушійну силу Холла Еу і за нею визначали n’. Виявилось що ця величина для лужних металів складає 1,1-1,3; для Ве та магнію -0,2 – - 0,4, а для тривалентних Al та In – - 0,3. Отже, теорія Друде не може пояснити, чому це так. Ця теорія не могла пояснити і додатній знак константи Холла, який спостерігався у деяких елементів, і залежність константи Холла від величини Н, і залежність електронної теплоємності від температури. Справді, вільні електрони підпорядковуються класичній теорії, а отже, на кожну ступінь вільності електрона припадає 1/2kТ енергії . Тоді електронна теплоємність Сv=dU/dT=3/2k, не повинна залежати від температури, хоча експеримент показує, що температурна залежність Сv(T) існує. Більше того, пізніші експерименти по визначенню електропровідності високо чистих металів показали, що σ в них набуває таких значень, що розраховане за теорією Друде значення Λ може бути ~ 1 см, що є нереальним.
Отже металевий зв'язок для свого розрахунку потребував інших, не класичних підходів. І такі спроби були зроблені спочатку Фермі. Він запропонував розглядати електронний газ у металах як вільний газ електронів, на які накладена заборона Паулі. Тобто, він запропонував розглядати електрони як квантові частки, енергія яких квантується, і на кожному енергетичному рівні може знаходитись не більше двох електронів. Ця спроба виявилась успішнішою, ніж теорія Друде, за її допомогою вже можна було пояснити, наприклад, температурну залежність електронної теплоємності. Хорошу провідність одних і погану провідність інших металів.
Н.Е.3. 1.-Н.Е.3.2. Лекція № 6.
Тема.Властивості і будова атомних ядер. Природне перетворення ядер.
План
1. Заряд і маса атомних ядер.
2. Енергія зв’язку ядра. Дефект маси.
3. Спін і магнітний момент ядер.
4. Ядерні сили та їх характеристика.
5. Моделі ядра. Краплинна та оболонкова моделі.
6. Природна радіоактивність. Радіоактивне випромінювання.
7. Закон радіоактивного розпаду. Правила зміщення.
Самостійна робота.
1. Закономірності радіоактивного a-розпаду.
2. Гамма-промені.
3. Ефект Месбауера та його застосування на практиці.
1. Досліди Резерфорда Ернеста. Будова атома. Модель атома Резерфорда. Розмір ядра ~ 10-15 м; заряд – додатний; маса атома зосереджена в ядрі. Будова ядра – складається з протонів і нейтронів, які називають нуклонами. Головна відмінність між нуклонами – заряд  - + 1,6*10-19Кл;
- + 1,6*10-19Кл;
1n - 0 Кл.
 Е=mc2=>
Е=mc2=> 
Перші моделі атомного ядра
 після відкриття Дж. Чедвіком нейтронів.
після відкриття Дж. Чедвіком нейтронів.
Складні ядра називають «нуклідами». Терміни «нуклід» і «ядро» еквівалентні. Кількість протонів у ядрі визначає заряд ядра Z, і збігається з порядковим номером елемента у таблиці Мендєлєєва Z. Заряд ядра Qя = Z×e; Z – зарядове число. (Нині відомі ядра із Z=1 до Z=109). Z+N=A – масове число N – ( ) нейтронів у ядрі => N=A-Z.
) нейтронів у ядрі => N=A-Z.
1а) Для позначення ядер -  ; Х – символ хімічного елемента;
; Х – символ хімічного елемента;
А – масове число;
Z – зарядове число.
Якщо  - ізотопи. Наприклад:
- ізотопи. Наприклад:  – протій;
– протій;  – дейтерій;
– дейтерій;  – тритій. Нині відомо ~ 300 стійких ізотопів хімічних елементів і > 2000 радіоактивних ізотопів.
– тритій. Нині відомо ~ 300 стійких ізотопів хімічних елементів і > 2000 радіоактивних ізотопів.
Якщо  ;
; 
 – ізобари;
– ізобари;  ;
; 

Якщо кількість нейтронів однакова – ізотони тобто N1=N2=N3;
A1-Z1= A2-Z2= A3-Z3; ;
;  ;
;  .
.
Розмір ядра характеризується радіусом ядра . Він трохи умовний. Розміри ядра розмиті. Метод вимірювання радіуса ядра базується на явищі дифракції на ядрах  ,
, 
 високих енергій.
високих енергій.
Досліди показали, що радіус ядра – можна записати як:
R=R0A1/3, де (R0≈1,3÷1,7*10–15м)
Середня густина ядерної рідини:
ρ= =
=  =
= =
=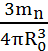 ≈1017(кг/м3).
≈1017(кг/м3).
2. Енергія зв’язку. Ядра – є стійкими утвореннями. Отже між нуклідами існує певна взаємодія притягання, яка забезпечує стійкість, не зважаючи на відштовхування між протонами.
Мас - спекромометри дозволяють досить точно визначити масу ядер, розділяючи за допомогою електричних та магнітних полів пучки заряджених часток з різними питомими зарядами  .
.
Мас-спектрометричні дослідження показали, що mя <  m нукл.
m нукл.
Е= mc2; Ея <  Е нуклонів; Ея <
Е нуклонів; Ея <  Е -
Е -  Е нукл. = - Е зв., або
Е нукл. = - Е зв., або
Ея + Езв =  Е нукл.=> Езв=
Е нукл.=> Езв= Е нукл. - Ея => (Zmp+(A-Z)mn- Mя)*с2
Е нукл. - Ея => (Zmp+(A-Z)mn- Mя)*с2
= Δm*с2=> Δm – дефект маси.
Питома енергія зв’язку . Еm/m= характеризує стійкість атомних ядер.
характеризує стійкість атомних ядер.

 Eпит Для
Eпит Для  < A<
< A< Епит – досягає мах.
Епит – досягає мах.
 8,7 МеВ/нукл.
8,7 МеВ/нукл.

 А
А
28 138
Ці ядра – найстійкіші. При наростанні кількості нуклонів у ядрі > 138 питома енергія зв’язку починає спадати. Це зменшення пояснюється тим, що зростання кількості протонів веде до росту енергії відштовхування між ними.
3. Спін і магнітний момент ядра.
Ls = ћ – власний момент імпульсу ядра, S=
– власний момент імпульсу ядра, S= – спін нуклона.
– спін нуклона.
Тоді власний момент імпульсу ядра = ћ =
=  ћ.
ћ.
Крім власного моменту імпульсу, ядро має і орбітальний момент імпульсу руху нуклонів навколо спільного центра мас ядра. Тоді повний момент імпульсу ядра = векторній сумі власного і орбітального моменту імпульсу
L = ћ
= ћ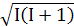 I – спінове ядерне квантове число, І=0;
I – спінове ядерне квантове число, І=0;  ;
;
Ядра з парним А мають цілочисельний спін; непарним - вимірюється у одиницях (ћ); І ≤ - для більшості ядер.
- для більшості ядер.
Із електродинаміки відомо, що магнітний момент зарядженої частки
Рm = j* Ls => Pmя = gя* L ; j*ћ =
; j*ћ = 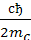 = мбgя*ћ=
= мбgя*ћ=  = мя
= мя
Зрозуміло, що  = 1836,5, тому
= 1836,5, тому  =
= .
.
Розміри і форма ядра. Дослідження розсіювання на ядрах показали, що на великих відстанях притягання ядер кулонівське. Але чим ближче до ядра, тим більше кулонівські сили замінюється на специфічні сили притягання, які швидко зростають. a - частки відштовхуються від ядра за законом Кулона, але при зменшенні відстані до ядра кулонівські сили слабнуть. Їх практично немає вже на відстанях r0~ 10-15м. Цей радіус дії ядерних сил і визначає радіус ядра. Радіус ядра Rя= r0 , де r0-1,3-1,5*10-15м, А- масове число. Отже середня густина ядерної речовини 1,3*1017кг/м3. Дослідження показують, що у ядер сферично-симетрична форма, але не всі ядра є сферично – симетричними, але всі ядра мають осьову симетрію (тобто можуть бути еліпсоїдами обертання).
, де r0-1,3-1,5*10-15м, А- масове число. Отже середня густина ядерної речовини 1,3*1017кг/м3. Дослідження показують, що у ядер сферично-симетрична форма, але не всі ядра є сферично – симетричними, але всі ядра мають осьову симетрію (тобто можуть бути еліпсоїдами обертання).
Спін і магнітний момент ядра. У 1928 році при дослідженні оптичних спектрів Na було виявлено, що його дублет D1 D2 має дублетну структуру D1(589нм.) складається з двох ліній і D2(589,6нм.) з двох.


 D1
D1
 I1
I1
 I2
I2
L1 =ћ
Таке розчеплення – називається надтонкою структурою спектральних ліній.
Паулі висунув гіпотезу, що це є наслідком існування спінів у ядра. Спін ядра - це його повний момент кількості руху ядра, який складається з моменту імпульсу його часток та їх орбітальних механічних моментів. Всі ядра з парним А мають цілий або О спін, а ядра з непарним А – ½ цілий спін.
Крім спіну, у ядер існує магнітний момент (µя= ), який виражається в ядерних магнетонах. Спіни ядер утворюються так, що спіни часток, з яких складається ядро, компенсують один одного. Бо спін ядра = Z ≠
), який виражається в ядерних магнетонах. Спіни ядер утворюються так, що спіни часток, з яких складається ядро, компенсують один одного. Бо спін ядра = Z ≠ .
.
Склад ядра. До 1932 року вважали, що ядро складається з протонів і електронів ; Х – має А- протонів; А-Z – електронів, які компенсують заряд.
– має А- протонів; А-Z – електронів, які компенсують заряд.
 Ве 9 протонів + 5 електронів = + 4, SBe =
Ве 9 протонів + 5 електронів = + 4, SBe =  ћ;
ћ;  +
+ ћ = 7ћ. Крім того, µя повинні бути > µб >> µя. Після 1932 року, коли відкрили нейтрон Іваненко і Гейзенберг запропонували p-n модель ядра (або нуклону)
ћ = 7ћ. Крім того, µя повинні бути > µб >> µя. Після 1932 року, коли відкрили нейтрон Іваненко і Гейзенберг запропонували p-n модель ядра (або нуклону)
4. Ядерні сили.
Протони позитивно заряджені тому на дуже близьких відстанях у атомному ядрі вони повинні були миттєво розлетітись. Але ядра стійкі утворення, тому вчені припустили, що між нуклонами існує інша взаємодія сильніша ніж кулонівська – сильна взаємодія. У 1934 р. російські вчені І. Е. Тамм та Іваненко Д. Д. створили теорію ядерних сил, згідно якої взаємодія між нуклонами виникає в результаті безперервного обміну легкими часткам . На той час відомими найлегшими частками були електрон і нейтрон:
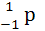 -
- -
- Ѵ =
Ѵ = n;
n;
 +
+ +
+  Ѵ =
Ѵ = h. В результаті цих процесів виникають сили притягання між
h. В результаті цих процесів виникають сили притягання між  і
і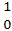 n. Розрахунки показали, що ядерна взаємодія за Таммом та Іваненком повинна була б бути у 1011 – 1013 разів слабшою за реальну (тобто кількісно теорія була хибною), а якісно ні! Японський фізик Хідеки Юкава припустив, що частина якою обмінюються
n. Розрахунки показали, що ядерна взаємодія за Таммом та Іваненком повинна була б бути у 1011 – 1013 разів слабшою за реальну (тобто кількісно теорія була хибною), а якісно ні! Японський фізик Хідеки Юкава припустив, що частина якою обмінюються  і
і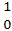 n у 200-300 раз важча за електрон. Цю частку назвали мезоном (від грец. «мезос» - середній), а потім Π – мезоном (піоном). Існують π+; π-; π0;
n у 200-300 раз важча за електрон. Цю частку назвали мезоном (від грец. «мезос» - середній), а потім Π – мезоном (піоном). Існують π+; π-; π0;
qп+= qп-= е = 1,6*10-19Кл.
маса π+=mп-=273 mе (140 МеВ), а mп0= 264 mе (135 МеВ).
Спін π+= π- = π0 =0 (тобто піон – бозон). τπ+ = τπ- = 2,6*10-8е; τπ =0,8*10-16.
Отже,  -
- n
n  p+
p+ = n +
= n + p
p
Атомне ядро розглядають як потенціальну яму, у якій містяться нуклони. Оскільки експерименти показують, що нуклони можуть приймати тільки певні порції енергії, тобто є квантовими частками, які знаходяться на певних енергетичних рівнях. Заповнення рівнів відбувається за принципом Паулі. Основному стану ядра відповідає такий розподіл, при якому заповнені всі нижчі енергетичні рівні. Якщо через якісь умови нуклони переходять на вищі енергетичні рівні – то такий стан ядра називають збудженим 
4а. Основні властивості ядерних сил.
1. Короткодійні (~10-15 м)
2. Зарядово-незалежні
3. Найпотужніші із усіх відомих сил
4. Мають здатність насичуватись (кожен нуклон взаємодіє з обмеженим
числом нуклонів;)
5. Залежать від взаємної орієнтації спінів (Наприклад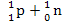 =
= (дейтерій) лише за умови, що їхні спіни паралельні).
(дейтерій) лише за умови, що їхні спіни паралельні).



6. Моделі атомного ядра. Єдиної теорії атомного ядра ще не існує. Щоб її створити необхідно розв’язати квантову задачу багатьох тіл. Яка задається масовим числом А. Тому для опису властивостей ядра використовують моделі. Одні – для одних властивостей; інші – для інших. Властивостей багато і моделей ядра існує досить багато. Розглянемо лише дві з них: краплинну і оболонкову.
6а. Краплинна модель. Запропонована в 1936 р. Я. І. Френкелем і розвинута далі в роботах датського фізика Нільса Бора.
Ядро – крапля зарядженої рідини. Між поведінкою нуклонів у ядрі і молекул в рідині є певні аналогії.
Нуклони.
1. Густина ядерної речовини однакова для всіх ядер і не залежить від – А.
2. Об’єм ~ кількості нуклонів.
3. <Е>енергія взаємодії ~8МеВ.
4. Сили взаємодії здатні до насичення.
5. Існує поверхневий натяг
Молекули.
1. Густина не залежить від розміру краплі.
2. Об’єм краплі ~ кількості молекул.
3. Е взаємодії має певне значення.
4. Аналогічно, сили взаємодії між двома молекулами слабо залежать від наявності інших молекул.
5. Існує поверхневий натяг.
Ця модель пояснює механізм ядерних реакцій.
Не може пояснити наявність спіну та магнітного моменту ядер.
6б. Оболонкова модель.
Експерименти показують, що властивості ядер змінюються періодично, як властивості атомів в періодичній системі елементів. Наприклад, для найбільш стабільних ядер число протонів (Z) або число нейтронів (A-Z) повинно дорівнювати таким числам 2;8;20;28;50;82;126 які називають магічними. Появу цих чисел змогла пояснити Оболонкова модель, запропонована у 1949-1950 рр. американським дослідником Гепперт- Маєром і німецьким вченим Йенсеном. Вони вважають, що рух нуклонів відбувається незалежно один від одного у деякому усередненому потенціальному полі, яке утворюється всіма нуклонами. Такий підхід дозволяє замінити задачу багатьох часток – задачею однієї частки, яка рухається у самоузгодженому прямокутному полі. У якості функції потенціальної енергії використовують потенційну яму, глибиною 50еВ і розв’язують рівняння Шредінгера для руху частки в такій ямі. Розв’язок рівняння Шредінгера показує, що стаціонарні стани частки характеризуються квантовими числами n, l, me. Енергетичні рівні розчіплюються на підрівні через існування стабільної взаємодії. Рівні заповнюються згідно до принципу Паулі. Рівні групуються в оболонки, на яких може знаходитися лише певна кількість нуклонів. Ядра з повністю заповненими оболонками – магічні – найстійкіші. Є двічі магічні ядра і по Z і по A-Z:  ;
;  ; Са, Рb.
; Са, Рb.
Властивості атомного ядра.
Заряд ядра. Визначається добутком Ze. У природі існують NZ=1-92. Інші елементи отримали штучно Z – визначає властивості атома.
Маса ядра . Інша важлива характеристика mя≈mа, бо  mр=mе для водню (а в інших атомах me
mр=mе для водню (а в інших атомах me а). Масу атома визначають за допомогою мас-спектрографів, які визначають масу іону за його відхиленням у магнітному та електронному полях. За допомогою мас-спектрографа було доведено, що існують атоми, які мають один заряд, але різну масу – ці атоми називають ізотопами. ma=в а. о. м. (
а). Масу атома визначають за допомогою мас-спектрографів, які визначають масу іону за його відхиленням у магнітному та електронному полях. За допомогою мас-спектрографа було доведено, що існують атоми, які мають один заряд, але різну масу – ці атоми називають ізотопами. ma=в а. о. м. ( ) або в уніфікованому (у а. о. м) (
) або в уніфікованому (у а. о. м) ( ). Маси ізотопів – мають цілі значення, тому вважають, що ядра складаються з цілого числа часток
). Маси ізотопів – мають цілі значення, тому вважають, що ядра складаються з цілого числа часток Поряд з ізотопами (
Поряд з ізотопами ( ) існують ізобари
) існують ізобари 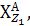

 - ізобари (наприклад,
- ізобари (наприклад,  ).
).
Стійкість ядер. Відомо ≈ 300 стабільних і 1000 радіоактивних ядер. Радіоактивні ядра – нестійкі, здатні самочинно розкладатись. Ступінь стабільності радіоактивних ядер визначають за часом піврозпаду – час протягом якого половина наявних ядер зазнає розпаду. ,
,  а часи піврозпаду різні, то такі ядра називають ізомерами.
а часи піврозпаду різні, то такі ядра називають ізомерами.
Читайте також:
- Аеродинамічні властивості колісної машини
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- Атрибутивні ознаки і властивості культури
- Білки, властивості, роль в життєдіяльності організмів.
- Біосфера Землі, її характерні властивості
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Будова і властивості аналізаторів
- Векторний добуток і його властивості.
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
| <== попередня сторінка | | | наступна сторінка ==> |
| Диполь-дипольні взаємодії. Ван-дер-ваальсовий зв’язок. | | | Визначення маркетингу й ключових понять курсу |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |