
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Білки, властивості, роль в життєдіяльності організмів.
Серед органічних сполук білки відіграють провідну роль. Вони часто переважають у клітинах і в кількісному відношенні: приміром, у клітинах тварин становлять до 40-50 % сухої маси, а рослин - до 20-35 %.
Будова білків.Білки – високомолекулярні нітрогеновмісні біополімери, мономерами яких є залишки амінокислот.
Залишки молекул амінокислот у складі білків сполучені між собою міцним ковалентним зв'язком, який виникає між карбоксильною групою однієї амінокислоти та аміногрупою іншої. Цей тип зв'язку називають пептидним(від грец. пептос - зварений).
Поліпептиди з високою молекулярною масою (від 6000 до кількох мільйонів) називають білками. Вони складаються з одного або декількох по- ліпептидних ланцюгів і можуть містити до кількох тисяч амінокислотних залишків.
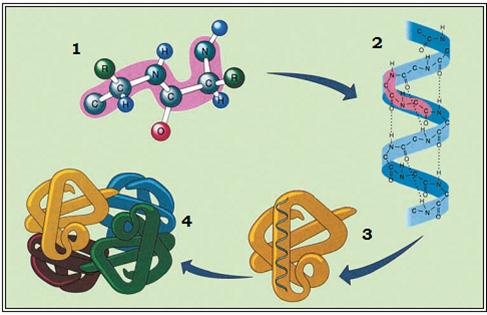
Рівні просторової організації білків. Відомо чотири рівні просторової організації, або конформації, білків: первинний, вторинний, третинний і четвертинний.
Первинну структуру білків визначає певна послідовність амінокислотних залишків, з'єднаних за допомогою пептидних зв'язків. Саме первинна структура і визначає властивості та функції тієї чи іншої білкової молекули. Часто молекула білка у вигляді такого ланцюга не придатна до виконання свого призначення. Для цього вона, наприклад, має повністю або частково закрутитися у спіраль, тобто набути вторинної структури завдяки водневим зв'язкам. Такі зв'язки виникають між атомами Гідрогену КН-групи одного витка спіралі та Оксигену СО-групи іншого витка спіралі. Хоча ці зв'язки значно слабші за пептидні, однак разом вони формують досить міцну структуру.
Третинна структура зумовлена здатністю поліпептидної спіралі закручуватися певним чином у грудку, або глобулу, завдяки зв'язкам, які виникають між залишками амінокислоти цистеїну (так звані дисульфідні зв'язки). Підтримання третинної структури забезпечують гідрофобні, електростатичні та інші взаємодії, а також водневі зв'язки. Гідрофобні взаємодії – це сили тяжіння між неполярними молекулами або між неполярними ділянками молекул у водному середовищі. Гідрофобні залишки усяких амінокислот у водному розчині зближуються, наче «злипаються», та стабілізують структуру білка.
Електростатичні зв'язки виникають між негативно та позитивно зарядженими радикалами залишками амінокислот.
Четвертинна структура білків виникає, коли об'єднуються кілька глобул. Наприклад, молекула гемоглобіну складається з чотирьох залишків молекул білка міоглобіну.
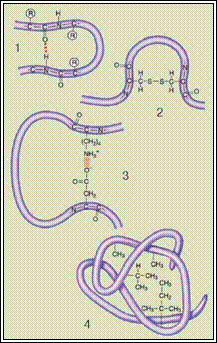 Мал. Зв'язки, які підтримують конформації білкової молекули: 1 - водневі; 2 - дисульфідні; 3 - йонні взаємодії; 4 - гідрофобні взаємодії.
Мал. Зв'язки, які підтримують конформації білкової молекули: 1 - водневі; 2 - дисульфідні; 3 - йонні взаємодії; 4 - гідрофобні взаємодії.
Мал. Рівні просторової організації білкових молекул: 1 – первинний; 2 – вторинний; 3 – третинний; 4 – четвертинний
Залежно від хімічного складу білки поділяють на прості та складні. Прості, або протеїни, складаються лише з амінокислотних залишків, а складні, або протеїди, у молекулах містять також небілкові компоненти - залишки ортофосфатної та нуклеїнових кислот, вуглеводів, ліпідів, атоми Феруму, Цинку, Купруму тощо. Складні білки називають глікопротеїдами (сполуки з вуглеводами), ліпопротеїдами (з ліпідами), нуклеопротеїдами (з нуклеїновими кислотами) тощо. Багато білків утворюють складні комплекси з пігментами - забарвленими у різні кольори органічними сполуками.
Властивості білків.Функціональні властивості білків зумовлені їхнім амінокислотним складом і просторовою структурою. За формою молекул розрізняють:
· фібрилярні (ниткоподібні)
· глобулярні (кулясті) білки.
Фібрилярні білки зазвичай нерозчинні у воді й виконують структурну (наприклад, кератин входить до складу волосся людини або шерсті тварин) або рухову (м'язові білки) функції. Натомість глобулярні білки здебільшого водорозчинні та виконують інші функції: наприклад, гемоглобін забезпечує транспорт газів, пепсин - розщеплення білків їжі, імуноглобуліни (антитіла) - захисну. Глобулярні білки менш стійкі (пригадайте з власного досвіду: білок курячих яєць навіть за незначного підвищення температури легко змінює свою структуру).
Одна з основних властивостей білків – їхня здатність під впливом різних чинників (дія концентрованих кислот і лугів, важких металів, високої температури тощо) змінювати свою структуру і властивості. Процес порушення природної структури білків, який супроводжується розгортанням білкової молекули без зміни її первинної структури, називають денатурацією. Здебільшого денатурація необоротна. Але якщо на початкових стадіях денатурації припиняється дія чинників, що призвели до неї, білок може відновити свій початковий стан. Це явище називають ренатурацією. У живих організмів оборотна денатурація часто пов'язана з виконанням певних функцій білковими молекулами: забезпеченням рухів, передачею до клітини сигналів з навколишнього середовища, прискоренням біохімічних реакцій тощо. Необоротний процес руйнування первинної структури білків називають деструкцією.
Читайте також:
- Аксіоми безпеки життєдіяльності.
- Аксіоми безпеки життєдіяльності.
- Актуальність безпеки життєдіяльності. Сталий розвиток людини
- Актуальність і завдання курсу безпека життєдіяльності. 1.1. Проблема безпеки людини в сучасних умовах.
- Аналіз ризику в життєдіяльності людини.
- Апарат управління безпекою життєдіяльності
- Бактеріофаг, його природа і практичне застосування. Вплив бактеріофага на мінливість мікроорганізмів.
- БЕЗПЕКА ЖИТТЄДІЯЛЬНОСТІ
- Безпека життєдіяльності людини в умовах натовпу
- Безпека життєдіяльності людини – найважливіше завдання людської цивілізації
- Безпека життєдіяльності як категорія
- Безпека» і «небезпека» як ключові категорії в безпеці життєдіяльності
| <== попередня сторінка | | | наступна сторінка ==> |
| Полісахариди, властивості, роль в життєдіяльності організмів. | | | Функції білків |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |