
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Диполь-дипольні взаємодії. Ван-дер-ваальсовий зв’язок.
Атоми інертних газів мають заповнені електронні оболонки, тому атом в цілому є елетронейтральною часткою. Між такими атомами відсутня кулонівська взаємодія. Однак між ними може виникати інший тип взаємодії - диполь-дипольна. Справді внаслідок руху атомів створюються миттєві електричні диполі, що появляються в результаті не збігання геометричного центру електронної хмаринки та ядра атома. Миттєвий диполь з дипольним моментом Р1 створює у центрі іншого атома, який знаходиться на відстані R, електричне поле, в системі СГС:
 (1)
(1)
Це електричне поле індукуватиме у центрі другого атома миттєвий дипольний момент, який визначається співвідношенням:
 , (2)
, (2)
де  - поляризованість другого атома. Отже
- поляризованість другого атома. Отже  . З електростатики відомо, що енергія взаємодії двох диполів рівна
. З електростатики відомо, що енергія взаємодії двох диполів рівна
 (3)
(3)
і оскільки  паралельні, то
паралельні, то 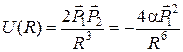 . З останнього виразу видно, що між диполями виникає енергія притягання
. З останнього виразу видно, що між диполями виникає енергія притягання  . Нейтральні атоми починають притягуватись до того часу поки вони не зблизяться на віддалі, при яких розпочнеться інтенсивне кулонівське відштовхування електронних оболонок різних атомів. В результаті спільної дії притягання та відштовхування між атомами встановиться рівноважна віддаль, при якій сили притягання будуть урівноважуватись силами відштовхування. Зазвичай потенціал відштовхування записують у вигляді:
. Нейтральні атоми починають притягуватись до того часу поки вони не зблизяться на віддалі, при яких розпочнеться інтенсивне кулонівське відштовхування електронних оболонок різних атомів. В результаті спільної дії притягання та відштовхування між атомами встановиться рівноважна віддаль, при якій сили притягання будуть урівноважуватись силами відштовхування. Зазвичай потенціал відштовхування записують у вигляді:
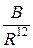 або
або  , (4)
, (4)
де величини B, l, r - деякі константи матеріалу.
Сумарний потенціал записують у вигляді:
 (5)
(5)
і називають потенціалом Ленарда-Джонса, або «6-12».
Його часто записують через безрозмірні параметри  - характеризує радіус відштовхування (радіус серцевини атомів, що відштовхуються) і
- характеризує радіус відштовхування (радіус серцевини атомів, що відштовхуються) і  - характеризує силу притягання (в еВ).
- характеризує силу притягання (в еВ).
 (6)
(6)
Таблиця 1.
| Параметр | Ne | Ar | Kr | Xe |
| e, (еВ) | 0.0031 | 0.0104 | 0.0140 | 0.0200 |
| s, (Å) | 2.74 | 3.40 | 3.65 | 3.98 |
*
Потенціал «6-12» визначає енергію взаємодії двох миттєвих диполів. Для того, щоб розрахувати енергію взаємодії кристалу, необхідно врахувати взаємодію всіх пар диполів, які виникають у кристалі.
Знайдемо енергію взаємодії атома, розміщеного у початку координат, з усіма іншими атомами.
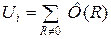 (7)
(7)
 (8)
(8)
У цьому виразі використані так звані безрозмірні ґраткові суми (Ro/R)n = Cn . Значення цих сум для різних n та різних типів ґраток наведені в таблиці.
Таблиця 2. Безрозмірні граткові суми для простої кубічної гратки..
| n | |||||||
| ПК | 16,53 | 8,40 | 6,95 | 6,43 | 6,20 | 6,10 | 6,05 |
| ОЦК | 22,64 | 12,25 | 10,36 | 9,56 | 9,11 | 8,82 | 8,61 |
| ГЦК | 25,34 | 14,45 | 12,80 | 12,31 | 12,13 | 12,06 | 12,03 |
Рівноважну віддаль Ro між найближчими атомами можна знайти із співвідношення: 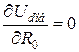 .
.
Використавши співвідношення для 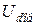 та дані таблиці, отримаємо таке теоретичне значення рівноважної відстані
та дані таблиці, отримаємо таке теоретичне значення рівноважної відстані
 (9)
(9)
Підставивши це значення у формулу для 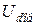 , отримаємо питому повну енергію, тобто енергію у розрахунку на одну частинку:
, отримаємо питому повну енергію, тобто енергію у розрахунку на одну частинку:
 (10)
(10)
Цей вираз дозволяє встановити тип ґратки з мінімальним значенням Uпит, порівнявши відношення ґраткових сум, що стоїть у правій частині рівняння для різних типів ґраток ПК,ОЦК, ГЦК.
Таблиця 3.
| Тип ґратки | ПК | ОЦК | ГЦК |
Значення
| 5,63 | 8,23 | 8,6 |
Аналіз цих даних показує, що мінімальною енергією володіє ГЦК гратка, що добре узгоджується з експериментальними даними, які свідчать, що всі кристали інертних газів володіють гранецентрованою кубічною граткою. До речі, не зважаючи на високо симетричну гратку, молекулярні структури – це рихлі структури з малим координаційним числом, з низькими температурами плавлення, з малими теплотами плавлення і випаровування, з великою стисливістю. За електричними властивостями молекулярні кристали – діелектрики. Як правило, прозорі для електромагнітних хвиль аж до далекої ультрафіолетової області.
Маючи повну енергію, можна розрахувати модуль всестороннього стискування  (в розрахунку на одну частку).
(в розрахунку на одну частку).
 (11)
(11)
Для знаходження треба встановити залежність між об¢ємом гратки та відстанню між частками. Оскільки в ГЦК гратку входять 4 атоми, то об¢єм однієї частки рівний
треба встановити залежність між об¢ємом гратки та відстанню між частками. Оскільки в ГЦК гратку входять 4 атоми, то об¢єм однієї частки рівний  (а- ребро куба гратки). В свою чергу найблища відстань між атомами в ГЦК гратці
(а- ребро куба гратки). В свою чергу найблища відстань між атомами в ГЦК гратці 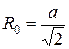 . Тому
. Тому  і
і  . Тоді з урахуванням умови, що
. Тоді з урахуванням умови, що  , для модуля всестороннього стиску дістанемо:
, для модуля всестороннього стиску дістанемо:
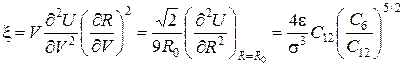 . (12)
. (12)
Для ГЦК гратки отримаємо 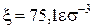 . У таблиці наведені розраховані та експериментальні дані для
. У таблиці наведені розраховані та експериментальні дані для 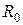 , Uпит,
, Uпит,  та Тпл для кристалів інертних газів.
та Тпл для кристалів інертних газів.
Таблиця 4.
| Параметр | Ne | Ar | Kr | Xe | |
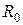 (Å) (Å)
| Експерим. | 3.13 | 3.75 | 3.99 | 4.33 |
| Теорія | 2.99 | 3.71 | 3.98 | 4.34 | |
| Uпит, | Експерим. | -0.02 | -0.080 | -0.116 | -0.17 |
| Теорія | -0.027 | -0.089 | -0.120 | -0.172 | |
 (1010
Дин/см2) (1010
Дин/см2)
| Експерим. | 1.1 | 2.7 | 3.5 | 3.6 |
| Теорія | 1.81 | 3.18 | 3.46 | 3.81 | |
| Тпл (К) | Експерим. |
З аналізу наведених у таблиці даних випливає, що відмінності між обчисленими та експериментально виміряними величинами зменшуються з ростом атомного номера елемента. Це пояснюється неврахуванням внеску кінетичної енергії нульових коливань у повну енергію системи. З ростом Z елемента вклад енергії нульових коливань зменшується. Інший важливий висновок з таблиці вказує на кореляцію між енергією зв’язку та температурою плавлення кристалів.
Уперше на існування сил притягання, зумовлених існуванням дипольних моментів вказав ван-дер-Ваальс для газів та рідин. Тому ці сили і дістали назву ван-дер-ваальсових сил.
Взаємодія, яка виникає при утворенні миттєвих диполів, називається дисперсійною. Крім неї, існують так звані індукційна взаємодія та орієнтаційна взаємодія. Перша реалізується тоді, коли в системі є постійний електричний диполь однієї молекули, який поляризує інші молекули. Взаємодія виникає між постійним та наведеним електричними диполями.
У другому випадку всі молекули системи мають постійний дипольний момент, тоді між ними виникають звичайні орієнтаційні взаємодії. При цьому вираз для енергії індукційної взаємодії, та орієнтаційної взаємодії аналогічний до виразу для дисперсійної взаємодії Uінд (орієнт)=- а2(а3)/r6, де а2 і а3 – постійні матеріалів з індукційною, та орієнтаційною взаємодіями, відповідно:
 і
і  (13)
(13)
Лекція 3№. Іонний зв'язок. Властивості іонних кристалів. Енергія іонного зв'язку.
Іонний зв'язок виникає між атомами, які мають невелику кількість валентних електронів, і атомами, електронні оболонки яких майже заповнені.
Для відриву електрона від атомів першого типу, треба затратити енергію, яка має назву енергії іонізації І-. Іони, які при цьому утворюються називаються катіонами. Приєднання електронів до атомів другого типу приводить до появи аніонів – негативно заряджених іонів. В ході такого процесу можна мати як виграш в енергії, так і затрати. Утворення однозарядних аніонів супроводжується виграшем в енергії. А утворення двозарядних іонів – потребує затрати енергії. Так, приєднання одного електрона до атома кисню супроводжується виділенням 1,46 еВ енергії, а приєднання другого електрона для утворення аніона О2- є вже енергетично невигідним. Енергія, яка виділяється при утворенні аніонів називається енергією електронного споріднення І+.
Здатність атомів до утворення іонного зв'язку визначаєтьсяенергією іонізації та енергією електронного споріднення. Для опису такої здатності Маллікен ввів поняття електронегативності c:
 , яка характеризує здатність атома, що бере участь у хімічному зв’язку, притягати валентні електрони. Тоді іонний характер зв’язку між двома атомами А та В визначається різницею електронегативностей cА - cВ.
, яка характеризує здатність атома, що бере участь у хімічному зв’язку, притягати валентні електрони. Тоді іонний характер зв’язку між двома атомами А та В визначається різницею електронегативностей cА - cВ.
Полінг побудував іншу шкалу електронегативності. Спочатку він увів величину DАВ, яка являє собою різницю (у еВ) між дійсною енергією дисоціації молекули АВ та значенням енергії, обчисленої на основі ковалентної структури А-В. Е(А-В) = (Е(А-А)·Е(В-В)) ½. Далі Полінг припустив, що  .
.
Цікаво, що шкали електронегативностей за Полінгом та Малікеном пов’язані між собою лінійною залежністю c М= 2.78cП.
Експериментальні дані свідчать про те, що при утворенні іонів розмір частки змінюється. Особливо суттєво змінюється розмір катіона. Так, наприклад, r(Na)=0.171нм r(Na+)=0.098 нм, оскільки зникає ціла електронна орбіталь (3s- орбіталь). При створенні аніона атом приєднує один або два електрони на тій же електронній оболонці, тому розмір аніона суттєво не змінюється (так, для хлору r(Cl) = 0.179 нм, r(Cl-) = 0.181нм).
Зміна геометричних розмірів катіонів та невелика зміна розмірів аніонів приводить до суттєвого перерозподілу електронної густини в іонному кристалі. Виміряне різними експериментальними методами (рентгенографічним, поглинанням в ІЧ області спектра та іншими методами) число електронів, які належать одному катіону чи аніону не є цілочисельним, а характеризується ефективним зарядом Z’=ne, де n – хімічна валентність, e - ступінь іонізації атома, яку можна визначити по-різному:
За Малікеном
 (1)
(1)
або за Полінгом:
 (2)
(2)
Експериментальні дані свідчать також про те, що в значній області між катіонами та аніонами значення електронної густини практично рівне нулеві.
Сума радіусів катіона та аніона є меншою, ніж між іонна віддаль:
d(Na+-Cl-)= rNa+ + rCl- + D, (3)
де D - мінімальна віддаль від заповненої оболонки катіона до орбіталі, на якій можуть розміщуватися наступні електрони, не залежно від того, чи ці електрони формуватимуть зовнішню орбіталь нейтрального атома, чи входитимуть в оболонку аніона. Ці результати дозволяють розглядати модель іонного кристалу, як системи непроникливих взаємодіючих заряджених кульок і розрахувати енергію зв’язку іонного кристалу як суму енергій взаємодії між всіма парами іонів.
Загальна характристика іонного зв’язку. Властивості іонних кристалів.
Іонний зв'язок малонаправлений, для нього характерні великі координаційні числа, щільні упаковки. До іонних кристалів належать більшість діелектриків. Їх електропровідність при кімнатних температурах на 20 порядків менша, ніж у металів. При підвищенні температури провідність росте. На відміну від металів, електропровідність іонних кристалів здійснюється за рахунок руху іонів, що пов’язано з переносом маси, тоді як при електронній провідності перенос маси відсутній.
Іонні кристали прозорі для електромагнітних хвиль в широкій області частот, аж до деякої граничної частоти, яка відповідає власній частоті коливань іонів в гратці.
Енергія взаємодії іонних кристалів
Кулонівська енергія взаємодії між іонами із зарядами ±е рівна
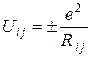 , (4)
, (4)
де Rij – відстань між центрами іонів, знаки плюс та мінус відповідають однойменним, та різнойменним іонам. У кристалі енергію взаємодії і-го іона з іншими іонами записують у вигляді:
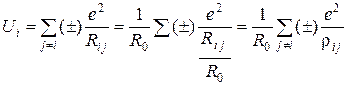 , (5)
, (5)
де rij = Rij/R0.
Повна енергія одного моля кристала рівна
 , (6)
, (6)
де  - постійна Маделунга, NA – постійна Авогадро.
- постійна Маделунга, NA – постійна Авогадро.
Величина А – це знакозмінний ряд, який є умовно збіжним, тобто збігається повільно. Це означає, що значення суми певного числа його членів буде довільним в залежності від порядку підсумовування. З фізичної точки зору така неоднозначність пов’язана з тим, що при різних способах підсумовування неоднаковими будуть поверхневі заряди, внесок яких враховується в суму. Тому для отримання однозначного результату внесок поверхневих зарядів треба зробити незначним. Тобто для його розрахунку необхідно вибрати об’єми такої форми, у яких вклад зарядів на поверхні цього об’єму в загальну суму зарядів був незначним. Найпоширеніші методи вибору таких об’ємів були запропоновані Евєном та Евальдом.
Однак, крім сил притягання, в кристалах діють і сили відштовхування.
Борн припустив, що
 , (17)
, (17)
де b, n – константи матеріалу. Тоді для моля кристала повну енергію можна записати
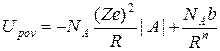 - потенціал Борна. (18)
- потенціал Борна. (18)
Константу b можна знайти, розглядаючи енергію кристалу при Т=0 К. У цьому випадку випливає, що енергія зв’язку при рівноважній відстані r=Ro повинна бути мінімальною.
 (19)
(19)
Звідки  , а повна енергія кристала буде
, а повна енергія кристала буде
 . (20)
. (20)
Рівноважну відстань знаходять з рентгеноструктурних досліджень, а показник потенціалу сил відштовхування з експериментальних даних по стисливості кристала.
Справді коефіцієнт стисливості β визначається із співвідношення
 , (21)
, (21)
де Vo- вихідний об’єм кристала, що відповідає Ro.
Виразимо через енергію кристала. Оскільки dU= -pdV+TdS, то при Т = 0 К dU= -pdV.
через енергію кристала. Оскільки dU= -pdV+TdS, то при Т = 0 К dU= -pdV.
Отже,
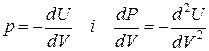 . (22)
. (22)
Крім того, стисливість кристала ξ, яка визначається із співвідношення ξ = 1/ β, може бути записана як
 . (23)
. (23)
Для знаходження встановимо залежність між об’ємом та рівноважною відстанню між іонами. Запишемо об’єм як
встановимо залежність між об’ємом та рівноважною відстанню між іонами. Запишемо об’єм як 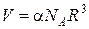 , де α – константа, що визначається типом гратки.
, де α – константа, що визначається типом гратки.
Тоді
 . (24)
. (24)
А  . (25)
. (25)
Знайдемо тепер dU/dR
 . (26)
. (26)
Тоді
 . (27)
. (27)
Підставивши в цю рівність b, матимемо . І підставивши це значення в формулу для модуля усестороннього стискування отримаємо:
. І підставивши це значення в формулу для модуля усестороннього стискування отримаємо:
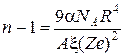 (28)
(28)
Для кристалу NaCl α=2; R=0,281 нм, А=1,75;ξ=3,3×1012 дин/см2. Перейшовши в систему СІ, та врахувавши заряд електрона 1,6×10 -19 Кл. Отримаємо n = 8. Для інших лужно-галоїдних кристалів цей показник різний і змінюється від 6 (LiF) до 12 (CsJ).
Однак розглянувши природу сил відштовхування Борн і Маєр прийшли до висновку, що потенціал відштовхування краще записати у вигляді:  . Тоді потенціали для пари іонів можна записати у вигляді:
. Тоді потенціали для пари іонів можна записати у вигляді:
 – потенціал Борна-Майєра. (29)
– потенціал Борна-Майєра. (29)
При рівноважному значенні R, коли потенціал взаємодії досягає мінімуму будемо мати:
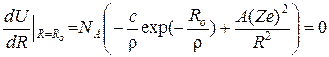 . (30)
. (30)
Звідки
 . (31)
. (31)
Тоді
 . (32)
. (32)
Рівноважну віддаль знаходять із рентгеноструктурних досліджень, ρ – за допомогою модуля всеcтороннього стискування:
 (33)
(33)
Отже повну енергію іонного кристалу можна розрахувати за рівноважною відстанню та за модулем стискування. З таблиці видно, що експериментальні та розрахункові значення енергії лужно-галоїдних кристалів досить непогано співпадають між собою
Таблиця 6. Параметри іон-іонної взаємодії в лужно-галоїдних кристалах.
| Ro (A) | B(1011 дин/см2 ) | ρ (A) |  (ккал/моль) (ккал/моль)
|  (ккал/моль) (ккал/моль)
| |
| NaCl | 2.820 | 2.40 | 0.321 | -182.2 | -178.6 |
| NaJ | 3.236 | 1.51 | 0.345 | -163.2 | -156.6 |
| KCl | 3.147 | 1.74 | 0.326 | -165.8 | -161.6 |
| KJ | 3.533 | 1.17 | 0.348 | -.149.9 | -144.5 |
Читайте також:
- Водневий зв’язок.
- Гармонічні коливання. Диференціальне рівняння гармонічних коливань та його розв’язок. Амплітуда, фаза, частота, період коливань
- Загальний вираз енергії міжмолекулярної взаємодії.
- Зв’язки і співпраця із ЗМІ – механізм взаємодії.
- Іонний зв’язок.
- Ковалентний зв’язок.
- Компоненти системи профорієнтації, їх функціонування і взаємозв’язок.
- Культура та цивілізація: проблеми взаємодії.
- Культура, формація і цивілізація, їх взаємозв’язок. Проблема спрямованості історії
- Механізм соціальної взаємодії.
- Мислення і мова, їх взаємозв’язок.
| <== попередня сторінка | | | наступна сторінка ==> |
| Класифікація та характеристики хімічного зв’язку | | | Лекція №5. Металевий тип зв’язку. Властивості металевих кристалів. Метали в наближенні вільних електронів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |