
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Алкіни. Хімічні властивості
Алкіни – це вуглеводні, що містять потрійний зв’язок СºС і мають загальну формулу CnH2n-2. Алкіни утворюють гомологічний ряд, який починається з ацетилену, а інші члени гомологічного ряду, як і члени рядів алканів і алкенів, відрізняються між собою на гомологічну різницю СН2 . За номенклатурою ІUРАС назви алкінів утворюються заміною в назві відповідного алкану суфіксу – ан на суфікс –ин(ін).
Ізомерія алканів зумовлена будовою вуглецевого ланцюга і розміщення потрійного зв’язку.
Хімічні властивості ацетиленових вуглеводнів зумовлені наявністю в їх молекулах потрійного зв’язку, який складається з одного s - зв’язку (утвореного двома sp – гібридизованими орбіталями вуглецевих атомів) і двох p - зв’язків (утворених вільними р – орбіталями), що орієнтовані у просторі у взаємно перпендикулярних площинах (рис.11):
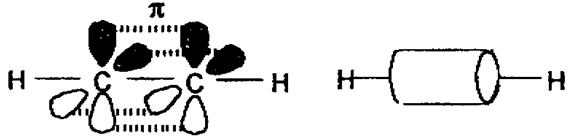
Рис.11. Схема утворення хімічних зв’язків в молекулі ацетилену
Молекула ацетилену є лінійною, всі чотири атоми розміщені на одній прямій. Обидві sp – гібридизовані орбіталі атома вуглецю скеровані під кутом 1800. p – електронна густина потрійного зв’язку має циліндричну симетрію відносно лінії сполучення ядер чотирьох атомів. На відміну від подвійного зв’язку, p – електронна густина потрійного зв’язку важче піддається поляризації, оскільки довжина потрійного зв’язку менша, ніж довжина подвійного зв’язку:
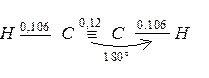
а електронегативність sp – гібридизованого атома гідрогену вища порівняно з sp2 – гібридизованим С – атомом. Тому, незважаючи на більшу ненасиченість, ацетиленові вуглеводні важче приєднують електрофільні реагенти, ніж етиленові вуглеводні. Для алкінів характерні реакції приєднання і, крім того, вони здатні заміщувати атом водню біля вуглецевого атома з потрійним зв’язком, тому що алкіни мають слабкі кислотні властивості:

Читайте також:
- OПТИЧНІ ВЛАСТИВОСТІ КОЛОЇДНИХ СИСТЕМ
- А) Товар і його властивості.
- Аеродинамічні властивості колісної машини
- Алкани (насичені вуглеводні). Хімічні властивості алканів
- Алкани, їх хімічні властивості.
- Алкени. Хімічні властивості
- Аміни. Фізичні та хімічні властивості аліфатичних амінів.
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- АНТИДЕТОНАЦІЙНІ ВЛАСТИВОСТІ
- Арифметичні дії над дійсними невід’ємними числами. Їхні властивості
| <== попередня сторінка | | | наступна сторінка ==> |
| Алкени. Хімічні властивості | | | Реакції приєднання |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |