
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Класифікація амінів
За кількістю аміногруп розрізняють:
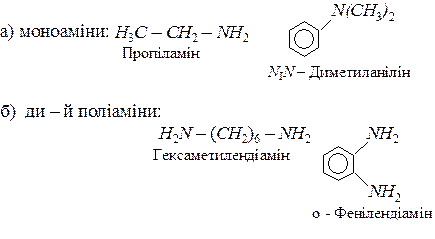
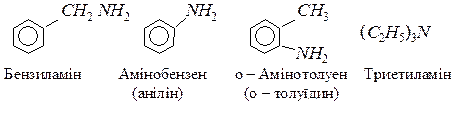
По кількості заміщених атомив гідрогену в молекулі амоніаку розрізняють первинні, вторинні і третинні аміни:

За систематичною номенклатурою назву аміну утворюють з назви відповідного вуглеводню додаванням префікса аміно-. За раціональною номенклатурою назви амінів утворюють додаванням суфікса – амін до назв радикалів; до того ж радикали перелічують за їх ускладненням. Для багатьох амінів використовують тривіальні назви.
У молекулах аліфатичних амінів атоми азоту перебувають в стані sp2– гібридизації. У тривалентному стані атом азоту має неподілену електронну пару, за рахунок якої він утворює донорно-акцепторний зв’язок з протоном, який має вакантну S – орбіталь:
R – NH2 + H+®R – NH3+.
Саме з наявністю неподіленої електронної пари на атомі азоту й пов’язані основні властивості амінів. У водних розчинах аміни приєднують протон води з утворенням гідроксидів амонійних сполук:
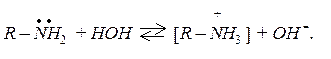
Реакція з бромною водою є якісною на анілін, при цьому утворюється осад 2,4,6 – триброманіліну.
Читайте також:
- II. Класифікація видатків та кредитування бюджету.
- V. Класифікація і внесення поправок
- V. Класифікація рахунків
- А. Структурно-функціональна класифікація нирок залежно від ступеню злиття окремих нирочок у компактний орган.
- Адміністративні провадження: поняття, класифікація, стадії
- Аміни. Фізичні та хімічні властивості аліфатичних амінів.
- Аналітичні процедури внутрішнього аудиту та їх класифікація.
- АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ. КЛАСИФІКАЦІЯ НЕОРГАНІЧНИХ СПОЛУК
- Базова класифікація ризиків підприємств
- Баланс енергій у видобувній свердловині і класифікація видобувних свердловин за способом їх експлуатації
- Банківська платіжна картка як засіб розрахунків. Класифікація платіжних карток
- Банківський кредит та його класифікація.
| <== попередня сторінка | | | наступна сторінка ==> |
| Аміни. Фізичні та хімічні властивості аліфатичних амінів. | | | Амінокислоти як мономери білків |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |